基于植物化感抑藻原理,室外进行灰化苔草( Carex cinerascens)不同淹没高度培养试验,在光照培养箱中采用批式培养法开展灰化苔草浸泡液化感抑藻研究。研究结果显示,在各淹没高度下灰化苔草浸泡液均对铜绿微囊藻( Microcystis aeruginosa)产生化感抑制作用,抑制率随淹没高度的增加而增加,至全淹时抑制率达到最高,抑制率从64%增加至82%;灰化苔草主要通过根系分泌和秆叶组织破坏后释放化感物质,活体完整灰化苔草化感物质分泌较少。灰化苔草浸泡液试验组中铜绿微囊藻细胞直径较对照组铜绿微囊藻细胞直径缩短10%左右,藻细胞产生固缩现象;铜绿微囊藻胞内和胞外多糖积累,含量分别为1.6~1.8和1.7~2.0 pg·cell-1,微囊藻胞外多糖的积累形成胞外胶鞘并单细胞形成群体以抵御化感抑藻的胁迫作用。本研究为采用生态调控水位实现植物化感抑藻提供基础试验数据。
In the present study, the allelopathy inhibition of Carex cinerascens soaking culture to Microcystis aeruginosa were studied with batch culture in light incubator controlling light and temperature and outdoors with different submerge height. The results showed that C. cinerascens soaking liquid inhibited the growth of M. aeruginosa and the inhibitory ratios increased with submerge height increasing which increased from 64% to 82%. C. cinerascens mainly secreted allelochemical by root system and dead or damaged tissues. Cell diameter of M. aeruginosa decreased by 10% compared with that of control group which suggested that the cells pyknosis. Intracellular and extracellular polysaccharide content of M. aeruginosa were 1.6~1.8 and 1.7~2.0 pg·cell-1, respectively. These results suggested that M. aeruginosa resist the allelopathic inhibitionby polysaccharide accumulation to form extracellular rubber sheath and single cells assembled to form group. This study provided the basis data forusing ecological regulation water level to control water bloom.
蓝藻水华(Cyanobacteria)导致水体生物化学性质发生改变和水体功能下降, 已成为全球性的环境问题。在我国, 大部分富营养化水体蓝藻水华以铜绿微囊藻(Microcystis aeruginosa)为优势藻种[1], 蓝藻水华对环境和社会经济造成巨大的损失[2], 有效防止蓝藻水华发生是当前水环境迫切需要解决的问题。
目前蓝藻水华治理主要采用物理、化学和生物方法, 如向水体直接投加化学杀藻剂(硫酸铜), 但该方法容易产生二次污染, 而且处理成本高, 很难用于天然水体蓝藻水华的治理[3]。植物化感抑藻是一种新的有效控制藻类水华的方法, 植物化感抑藻具有绿色、低成本、化感物质容易获得、热稳定性高和无二次污染等优点[4], 在应用上也具有很好的发展前景。
植物化感抑藻已受到广泛关注, 并开展了大量研究。研究发现, 水生植物、浮水植物、挺水植物和陆生植物具有化感抑藻能力[5, 6, 7], 如, 稻草浸泡液对铜绿微囊藻产生化感抑制作用[7]; 芦苇(Phragmites australis)的不同部位(根、地下茎、茎和叶片)水浸泡液均对蛋白核小球藻(Chlorella pyrenoidesa)产生抑制作用[8]; 植物(如再力花)根系分泌物对铜绿微囊藻和小球藻具有强的抑制作用[9, 10]; 有研究表明, 植物晾干后水浸泡过滤液对铜绿微囊藻产生抑制作用[11, 12], 植物释放化感物质方式各异。对植物化感物质主要通过破坏细胞膜、细胞形态、光合作用的限制和胞内酶活性等抑制藻类的生长[13, 14]。
在我国灰化苔草(Carex cinerascens)分布广泛, 多生于沼泽、湖边以及湿地, 鄱阳湖灰化苔草属根生植物, 具有较强生命力, 每年受鄱阳湖水情影响出现周期性生长-死亡交替[15], 水位波动对灰化苔草化感抑藻的研究鲜见报道。因此, 本研究以鄱阳湖洲滩灰化苔草为研究对象, 明确不同水位下灰化苔草水浸泡液的抑藻作用, 以期揭示淹没高度对植物化感抑藻的影响, 为通过调节水位利用湖、库湿地洲滩植物化感作用控制蓝藻水华提供试验数据。
蓝藻门铜绿微囊藻(Microcystis aeruginosa)购自中国科学院水生生物研究所。在500 mL锥形瓶中加入200 mL无菌培养基BG11[16], 放置在光照培养箱中, 保持温度在(29± 0.1) ℃, 光照强度2 500 lx, 光照周期为24 h, 每天摇动3次, 将处于对数生长期的藻种备用。
初夏在鄱阳湖南矶山湿地保护区采集灰化苔草及土壤(草甸土), 土壤厚度2 000 mm左右, 150 mm的正方形样方15块带回实验室进行培养试验, 去除样方中杂草及枯落物等, 仅保留活体灰化苔草, 统计各个样方所含灰化苔草的植株数(135± 4)株, 植株高度350 mm, 无显著差异(P> 0.05), 叶绿素a含量为2.4 mg· g-1, 土壤基本理化性质pH为5.3, 有机碳11.75mg· g-1, 全氮1.36 mg· g-1, 全磷0.51 mg· g-1, 碳氮比8.76, 氮磷比2.91。将样方置于钢化塑料圆桶中培养(上下直径分别为800和610 mm, 高800 mm), 桶底部铺垫砂60 mm, 再将植物样方置于砂层上进行培养, 将所有单元培养装置露天放置, 每天添加自来水补充蒸发水分, 用HH2型土壤水分仪(Moisture Meter)测定土壤水分含量, 将土壤表面植物剪除的一组作为浸泡液对照组。从2014年4月10日到2014年4月25日在室外培养15 d后灰化苔草发出新芽和新的根系, 已适应室内培养条件开始不同水位淹没试验, 测得叶绿素a含量为2.5 mg· g-1, 苔草根生物量为5 210 g· m-2。每组设置两组平行。
试验使用自来水作为淹没介质, 无草对照组和淹没根部组水深30 mm, 淹没中部组淹没高度200 mm, 全淹淹没高度350 mm, 蒸发水使用自来水补充; 从2014年4月25日到2014年5月29日连续淹没35 d后, 全淹没组灰化苔草枯黄死亡, 淹没底部组和半淹组灰化苔草生长良好, 分别取浸泡液过0.45 μ m滤膜, 备用。人工培养基BG11作为培养基对照组, 调节培养基中总氮、总磷浓度分别为2、0.2 mg· L-1。将配置好的培养液使用30 W紫外灯灭菌120 min后备用, 以实现无菌培养基。
试验采用锥形瓶批式培养法, 在光照培养箱中进行控温、控光无菌培养试验, 在250 mL锥形瓶中添加150 mL备用浸泡液, 培养温度、光照强度和光暗比与培养铜绿微囊藻藻种一致, 初始藻密度2.0× 105 cell· mL-1, 每天人工摇动3次, 再随机放置。培养装置使用30 W紫外灯杀菌2~4 h, 再进行培养实验; 实验过程中严格无菌操作, 每组设置3个平行组。
藻细胞计数采用血球板计数法, 在隔天08:30从摇匀后的培养基中吸取1 mL藻液至试管中, 吸取0.1 mL到血球计数板上在双面光学显微镜下计数, 3次计数取平均值; 采用显微镜拍相功能和图像分析软件测量细胞直径, 观察细胞形态变化; 采集至少200 个藻细胞, 用蒽酮乙酸乙酯-硫酸法测定细胞总糖和胞外多糖[17], 总糖减去胞外多糖即为胞内多糖; 培养液总氮(TN)和总磷(TP)分别使用过硫酸钾氧化法和钼锑抗分光光度法[18]; 叶绿素和类胡萝卜素含量的测定采用Arnon法[19]; 土壤pH值用智能型pHS-3C型pH计测定, 有机碳采用重铬酸钾容量-外加热法测定 。
IR= (N0-N)/N0× 100%.
式中, IR为抑制率, N0为人工培养基对照组中藻密度, N为试验组中藻密度。
将不同淹没高度得到的灰化苔草浸泡液作为培养基, 铜绿微囊藻细胞密度与培养时间关系作图得到微囊藻生长曲线(图1)。可以看出, 人工培养基中铜绿微囊藻密度均高于试验组中铜绿微囊藻密度, 无草对照组、淹没底部和半淹组灰化苔草培养液中铜绿微囊藻细胞密度相近, 仅含灰化苔草根土壤对照组与灰化苔草正常生长浸泡液中微囊藻生长相近; 在全淹组中灰化苔草枯黄死亡, 浸泡液发黄, 在浸泡液中铜绿微囊藻密度最低。
第10天灰化苔草浸泡液对铜绿微囊藻的抑制率达到最大值(图2)。在无草对照组和不同淹没高度试验组中微囊藻生长均受到抑制, 无草对照组与淹没底部试验组浸泡液培养基中铜绿微囊藻的抑制率相近, 约为64%, 半淹没培养条件下灰化苔草浸泡液对铜绿微囊藻的抑制率为71%, 全淹没培养条件下灰化苔草浸泡液对铜绿微囊藻抑制率最高为82%。
 | 图2 铜绿微囊藻抑制率注:a代表各试验组与人工对照组的显著差异(P< 0.05)。图3同。Note: a represent significant difference between treatments and control at 0.05 level. The same in Tab. 3.Fig.2 Inhibiton ratio of Microcystis aeruginosa |
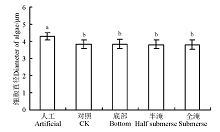
将各培养液中铜绿微囊藻细胞直径作图(图3)。培养第10天时, 在人工培养基中铜绿微囊藻细胞直径为4.3 μ m左右, 在无灰化苔草对照组和不同淹没高度浸泡液培养基中铜绿微囊藻细胞直径在3.78~3.83 μ m, 并且微囊藻细胞直径随淹没高度的增加呈降低的趋势, 在全淹试验组中微囊藻细胞直径最小, 为3.8 μ m; 灰化苔草浸泡液对照组和试验组中铜绿微囊藻细胞直径较人工培养基中铜绿微囊藻细胞直径显著降低(P< 0.05), 且他们间不存在显著差异(P< 0.05)。
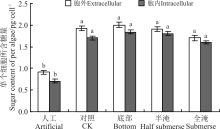
测定第6天培养基中微囊藻总糖和胞外多糖含量。灰化苔草浸泡液无草对照组和试验组中单个藻细胞内和胞外多糖含量均高于人工培养基中单个藻细胞内和胞外多糖含量, 较人工培养基分别增加了2.3~2.6倍和1.9~2.2倍; 单个藻细胞外多糖含量随淹没高度的增加呈先增加再降低的趋势, 无草淹没对照组与底部淹没试验组中胞外多糖含量差异较小, 胞外多糖含量分别为1.92和2.0 pg· cell-1, 全淹试验组中的胞外多糖含量最低, 为1.7 pg· cell-1; 胞内多糖含量变化趋势与胞外多糖含量变化趋势相似, 各试验组中单个微囊藻细胞胞内和胞外多糖无显著差异(P> 0.05), 与人工对照组存在显著差异(P< 0.05)。
植物化感物质释放方式主要通过植物体表茎、叶、花的挥发, 雨水或雾滴的作用产生淋溶, 根系通过分泌次生代谢产物和植物残株的腐烂释放等方式[20]。通过室内单元培养试验得到活体灰化苔草浸泡液对铜绿微囊藻生长产生抑制作用, 在无草对照组和淹没底部浸泡液对铜绿微囊藻的抑制率相近, 为64%左右, 可见灰化苔草根系分泌化感物质产生化感抑制; 当灰化苔草被淹没一半时, 抑制率增加7%, 这可能是部分灰化苔草被浸泡和淹没枯死共同所致, 当灰化苔草全部淹没枯死腐烂后对铜绿微囊藻的抑制率较人工对照增加18%。Qian等[9]研究发现, 铜绿微囊藻在水葫芦(Eichhornia crassipes)根系分泌物1 mg· L-1中连续作用96 h, 其抑制率为62%左右, Su等[7]将稻草浸泡在反渗透水中5 d后, 对铜绿微囊藻的抑制率约为78%。通过本研究分析得到鄱阳湖灰化苔草主要通过根系分泌和苔草腐烂释放化感物质。鄱阳湖灰化苔草根系和植株腐烂分泌的化感物质组成及释放动力学需进一步研究明确。
在无草淹没对照组和试验组中, 铜绿微囊藻细胞直径均较人工培养基中铜绿微囊藻细胞直径短; 微囊藻细胞直径随淹没高度的增加呈减小的趋势, 在全淹没试验组中微囊藻细胞直径最短; 微囊藻细胞直径缩短使得铜绿微囊藻细胞体积降低。研究芦苇(Phragmites communis)提取液对铜绿微囊藻的化感作用时, 也得到微囊藻细胞内金属离子渗出, 细胞体积缩小[21]; 使用不同极性甲醇、乙酸乙酯、正己烷提取芦竹(Arundo donax)化感物质, 分析其对铜绿微囊藻的化感作用, 发现铜绿微囊藻在化感作用下细胞直径缩短[22]。导致细胞减小的原因一方面是铜绿微囊藻细胞在化感物质作用下细胞膜上巯基被破坏, 细胞膜的完整性降低, 使微囊藻细胞内物质外流, 导致细胞缩小[23], 另一种原因可能是胞内外离子浓度差, 离子通道开放紊乱会导致渗透压改变, 引起藻细胞直径减小[24]; 铜绿微囊藻在化感物质的胁迫下微囊藻细胞固缩, 并随化感物质作用时间的延长, 其细胞最终缢裂死亡。Zhang等[25]在研究蛋白核小球藻与铜绿微囊藻相互化感抑制作用时, 得到微囊藻细胞在化感作用下细胞体积缩小, 最终缢裂死亡的相似结论。
在无草淹没对照组和各淹没试验组中, 铜绿微囊藻细胞受灰化苔草浸泡液中化感物质的胁迫, 微囊藻细胞生长减缓使胞外、胞内多糖积累, 较人工培养基中微囊藻胞外、胞内多糖含量高; 无草淹没对照组和淹没底部试验组中微囊藻胞内、胞外多糖含量最高, 在抑制率最高的全淹试验组中微囊藻胞内、胞外多糖含量最低。微囊藻细胞在化感作用下, 细胞生长受到抑制, 在较强化感作用下微囊藻细胞光学合成受到抑制[14, 26], 胞内合成的多糖不能被完全利用而积累, 为微囊藻生长提供能量; 微囊藻胞外多糖的积累形成胞外胶鞘以抵御化感物质的胁迫作用, 因此, 在无草对照和底部淹没处理抑制率相对较低时, 微囊藻胞外多糖积累相对较多; 另外, 微囊藻胞外多糖含量的增加有利于藻细胞形成群体[27], 显微镜下观察到微囊藻形成群体, 群体的形成也有利于抵御化感物质的抑制作用[28], 使得微囊藻在化感作用下可保持维持一定的生长。
1) 淹没高度较低时, 灰化苔草生长良好, 在浸泡过程中分泌化感物质较少, 全淹没时, 灰化苔草枯黄死亡, 此时分泌大量化感物质, 因此, 灰化苔草在较长时间浸泡后仍具有化感抑藻能力。
2) 通过室内培养, 鄱阳湖灰化苔草根系分泌和秆叶浸泡腐烂后得到过滤液对铜绿微囊藻产生化感抑制作用, 其抑制率随淹没高度的增加而增加, 在全淹没时达到最高。
3)鄱阳湖灰化苔草分泌的化感物质使铜绿微囊藻细胞直径缩小, 可能使微囊藻细胞产生固缩现象最终使细胞分解死亡; 同时在化感物质胁迫下微囊藻胞内、胞外多糖积累, 使微囊藻形成胞外胶鞘以抵御化感抑藻。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|