第一作者:杨春雪(1977-),女,黑龙江伊春人,副教授,博士,主要从事植物逆境生物学方面的研究。E-mail:[email protected]
为阐明松嫩盐碱草地主要盐生植物根围丛枝菌根(Arbuscular Mycorrhizae,AM)真菌多样性,本研究于2013年7月在黑龙江省肇东市西南部松嫩盐碱草地采集了11科26种植物根系和根际土壤,分离出5属40种AM真菌,其中球囊霉属( Glomus)和无梗囊霉属( Acaulospora)为优势属,根内球囊霉( Glomus intraradices)为优势种。蔓委陵菜( Potentilla flagellaris)根围孢子密度最大,达986.0 cfu·kg-1,扁蓄蓼( Polygonum aviculare)根围孢子密度最低,仅有452.3 cfu·kg-1。蒲公英( Taraxacum mongolicum)根围AM真菌种类最丰富,Shannon-Weiner指数(H)达到1.43。pH值与孢子密度和物种丰度均表现出显著负相关( P<0.05);土壤有机质和全氮量与孢子密度、物种丰度呈极显著正相关( P<0.01),与Shannon-Weiner指数呈显著正相关( P<0.05);土壤全磷量与孢子密度、物种丰度和Shannon-Weiner指数均表现为显著正相关关系( P<0.05)。
In order to explore the diversity of arbuscular mycorrhizal(AM) fungi in the rhizosphere of salt-tolerant plants in Songnen saline-alkaline grassland, 26 species of plants of 11 families from Songnen saline-alkaline grassland were gathered and 40 AM fungal species of five genus were isolated in July 2013. Glomus and Acaulospora were the dominant genus and Glomus intraradices was the dominant species. Density of the spore in the rhizosphere of Potentilla flagellaris were 986.0 cfu·kg-1 soil, which was the highest one among the 26 plant species, while that of the lowest one was Polygonum aviculare, with 452.3 cfu·kg-1 soil. The diversity of AM fungal species in the rhizosphere of Taraxacum mongolicum was the richest, with the Shannon diversity index of 1.43. pH value had a significantly negative correlations with spore density and species richness ( P<0.05), while soil organic and total nitrogen content correlated significantly positively with Shannon-Weiner ( P<0.05), and had a highly significantly positive correlation with spore density and species richness ( P<0.05). Total phosphorus content had a significant positive correlation with spore density, species richness and Shannon-Weiner ( P<0.05).
土壤盐渍化是世界各国面临的共同难题, 我国盐碱土面积已超过了370万hm2, 且正以每年1.4%的速度扩展[1], 松嫩平原地处半湿润半干旱过渡带, 因溶解在水中的盐分容易在土壤表层积聚, 盐碱地主要成分是苏打盐, 草甸土和盐碱常呈复合体形式分布[2, 3]。现今, 针对草地大面积盐碱化、退化等问题, 我国各级部门先后采取过以稻治碱、以水治碱等治理措施, 尽管投入了大量资金, 但土壤盐碱化始终没有得到治理。因此, 借助其他技术手段加以辅助和治理恢复草原生态系统就显得尤为重要。
丛枝菌根(Arbuscular Mycorrhizae, AM)真菌是土壤中广泛存在的一类共生真菌, 能与90%以上的高等植物形成丛枝菌根[4]。植物长期生活在高盐条件下会出现营养亏缺、离子毒害及氧化胁迫等症状[5], AM真菌能活化土壤, 调节植物渗透平衡, 增强植物对矿质元素和水分的吸收, 提高光合作用, 促进生物量的积累, 提高植物的耐盐能力[6, 7]。本研究探究松嫩盐碱草地中AM真菌的资源分布和多样性, 分析土壤因子与AM真菌生态分布和多样性之间的关系, 以期为筛选高效AM真菌菌种资源, 促进AM真菌在盐碱土改良中的应用提供参考。
本研究于2013年7月在黑龙江省肇东市周边松嫩盐碱草地采集了共11科26种耐盐植物根际土壤, 样点分布见表1。根据“ 多点平行取样法” 和“ 五点取样法” [8]按照东南西北4个方向随机对26种植物取样, 重复3次, 用小铲轻轻刮去地表的杂物, 向下垂直挖取12~20 cm深的植物根围土壤, 并保留粘附在植物根系表面的细土, 最后经“ 四分法” [8]保留1 kg土样, 统一编号后带回, 并记录采集时间、地点和周围环境。
| 表1 松嫩盐碱草地26种植物分布情况 Table 1 The distribution situation of 26 plants in Songnen saline-alkaline grassland |
采集的土壤样品自然风干, 每次称取土样100 g, 利用湿筛倾析-蔗糖离心法分离AM真菌孢子[9], 于实体显微镜下统计孢子密度、物种丰度和Shannon-Weiner指数(H); 轻挑孢子于载玻片上, 分别用水、乳酸、PVLG、Melzer’ s试剂为浮载剂制片, 在OLYMPUS CX21生物显微镜下观察孢子的颜色、纹饰、连孢菌丝等特征, 测量孢子大小、菌丝壁厚度、菌丝宽度, 拍照并记录。参照“ VA菌根鉴定手册” [10]和国际AM真菌菌种保藏中心(International Collection Center of Vesicular and Arberscular Mycorrhizal Fungi, INVAM)提供的AM真菌种属描述以及Internet(http://invam.caf.wvu.edu)上提供的图片, 并参阅近几年发表的有关AM真菌分类的相关资料和原始文献对AM真菌进行形态鉴定。
土壤理化性质参照《土壤农化分析》[11]和中国科学院南京土壤研究所的方法测定[12]。土壤pH值采用玻璃电极法, 用雷磁PHSJ-4A测定; 土壤全盐量采用浸出液电导率法, 用雷磁 DDSJ-308A测定; 土壤有机质采用重铬酸钾-浓硫酸法, 用数显JXX1-HH-8油浴锅测定; 土壤全氮量采用半微量凯氏法, 用ATN-1100全自动凯氏定氮仪测定; 土壤全磷量采用硫酸-高氯酸消煮法测定; 土壤全钾量采用NaOH熔融-火焰光度计法测定(上海, FP6450型火焰光度计)。
参考张美庆等[13]和秦燕燕等[14]的方法计算AM真菌孢子密度(Spore Density, SD)、物种丰度(Species Richness, SR)、分离频度(Frequency, F)、相对多度(Relative Abundance, RA)、Shannon-Wiener多样性指数(H)和重要值(Importance Value, IV)。
SD=AM真菌所有种的孢子数/土壤样本数;
SR=AM真菌总种数目/土壤样本数;
F=AM真菌某菌种出现的次数/总样本数× 100%;
RA=AM真菌某菌种的孢子数/AM真菌总孢子数× 100%。
利用Shannon-Wiener多样性指数(H)来描述AM真菌的物种多样性, H=
采用SPSS 17.0对AM真菌土壤理化性质和多样性指标进行单因素方差分析(Duncans)和多重比较(α =0.05), 用平均值和标准误表示测定结果; 分析土壤因子与AM真菌之间的相关性; 采用Microsoft Excel对数据进行处理和绘图。
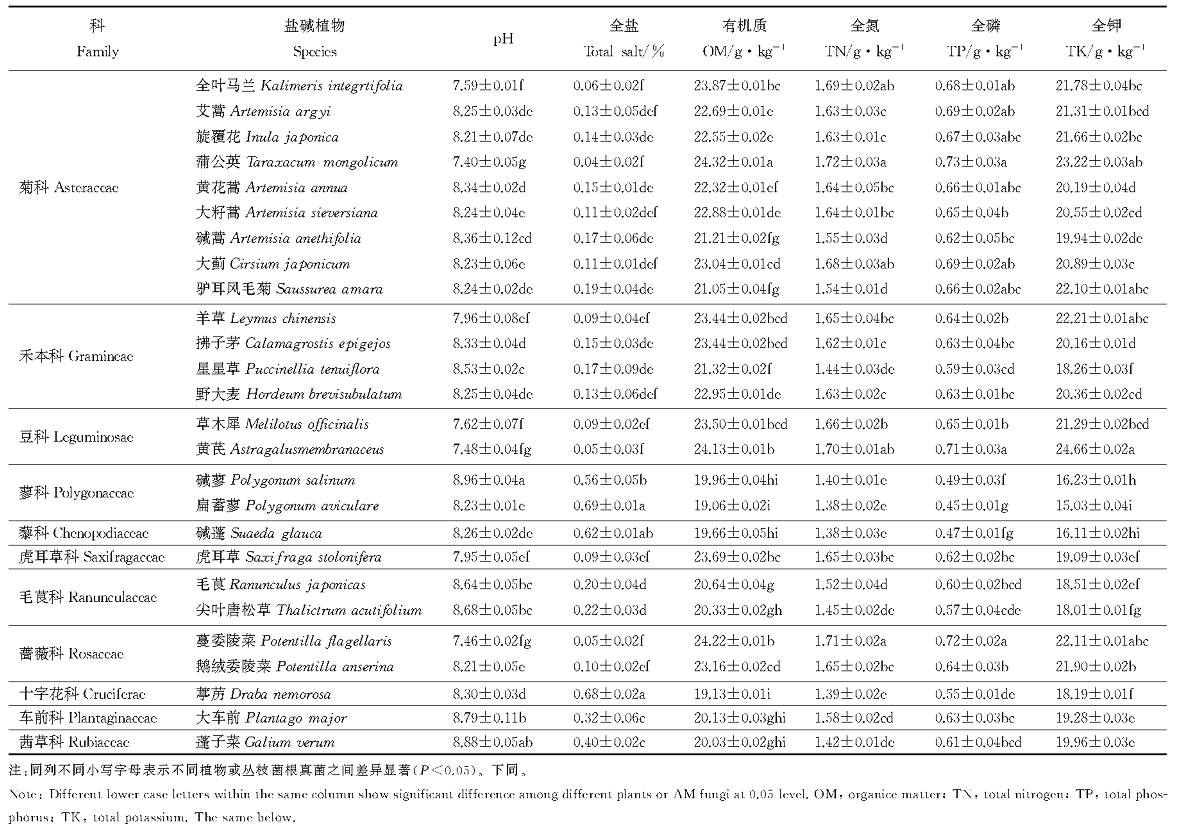
松嫩盐碱草地26种植物根际土壤的pH值和全盐量相差不大(表2), pH最高的植物为碱蓼, 达到了8.96, 最低的为蒲公英, 仅为7.40; 土壤全盐量平均为0.22%, 这表明松嫩盐碱草地属于中盐度土质。各植物根际土壤的有机质、全氮、全磷、全钾含量差异明显, 26种植物根际土壤的有机质含量平均值为22.03 g· kg-1, 全氮量平均值为1.57 g· kg-1, 全磷量平均值为0.63 g· kg-1, 全钾量平均值为22.12 g· kg-1。26种植物中, 土壤的有机质含量、全氮量、全磷量的最高值均出现在蒲公英根际, 分别为24.32、1.72和0.73 g· kg-1, 黄芪根际土壤的全钾含量达所有植物中的最高值, 为24.66 g· kg-1; 扁蓄蓼的有机质含量、全氮量、全磷量和全钾量均达到所有植物中的最低值, 分别为19.06、1.38、0.45和15.03 g· kg-1。
| 表2 盐碱植物根际土壤的化学性质 Table 2 Chemical properties of soil in salt tolerant plant rhizosphere |
从26种植物根围共分离出AM真菌5属40种(表3、图1), 已鉴定38种, 尚有两个未确定种(sp1和sp2)。其中球囊霉属(Glomus)21种, 占总种数的52.5%; 无梗囊霉属(Acaulospora)12种, 占总种数的30%; 盾巨孢囊霉属(Scutellospora)4种, 占总种数的10%; 巨孢囊霉属(Gigaspora)两种, 占总种数的5%; 和平囊霉属(Pacispora)只有玻利维亚和平囊霉(Pacispora boliviana)1种。根内球囊霉(Glomus intraradices)和地表球囊霉(G. versiforme)广泛分布在植物根围土壤中, 二者是研究地区的常见菌种; 极大巨孢囊霉(Gigaspora gigantea)、圆齿盾巨孢球囊霉(Scutellospora crenulata)和亮色盾巨孢球囊霉(S. fulgida)均只在一种植物根际土中出现, 是该地区的稀有菌种。
| 表3 26种植物根际土壤 AM 真菌资源及地区分布 Table 3 The resources and distribution of AM fungi in rhizosphere of the twenty six plants |
26种植物根际土壤中均有不同程度的AM真菌孢子存在(表4)。蒲公英的物种丰度和Shannon-Weiner指数均达到所有植物中的最高值, 分别为15.81和1.43; 蓼科植物AM真菌资源分布少, Shannon-Weiner指数低, 其中扁蓄蓼孢子密度、物种丰度和Shannon-Weiner指数均为所有植物中的最低值, 仅有452.3 cfu· kg-1、9.92和0.38。
| 表4 26种植物AM真菌孢子密度、种的丰度和Shannon-Winner多样性指数 Table 4 Spore density, species richness and Shannon-Winner diversity index of the AM fungi in 26 plant species |
试验结果表明, 球囊霉属的分离频率、相对多度和重要值在26种植物中较高, 是优势属; 无梗囊霉属为常见属, 巨孢囊霉属的重要值仅有3.01%, 是研究地的稀有属。根内球囊霉的分离频度、相对多度和重要值分别为80.77%、6.47%和43.62%, 是该研究区的优势菌种, 地表球囊霉仅次于根内球囊霉, 是常见菌种, 这表明二者对盐碱环境有较强的耐受力。极大巨孢囊霉、圆齿盾巨孢球囊霉和亮色盾巨孢球囊霉的重要值在26种植物中均相对偏低, 是研究区的稀有种(表5)。
| 表5 26种植物AM真菌分离频度、相对多度、重要值 Table 5 Frequency, relative abundance and importance value of the AM fungi in twenty six plants% |
试验结果表明, 土壤各因子与AM真菌多样性密切相关(表6), 土壤营养因子对AM真菌的影响要强于盐度因子, 其中pH值与孢子密度和物种丰度之间表现出显著负相关(P< 0.05), 而全盐量与AM真菌的孢子密度、物种丰度和多样性指数均没有显著相关性(P> 0.05); 土壤营养因子中, 有机质和全氮量对AM的影响最大, 其中有机质和全氮量与孢子密度、物种丰度呈极显著正相关(P< 0.01), 与多样性指数呈显著正相关(P< 0.05); 全磷量与孢子密度、物种丰度和多样性指数均表现出显著相关(P< 0.05), 而全钾量与孢子密度、物种丰度和多样性指数之间没有显著相关性(P> 0.05)。
| 表6 土壤特性与AM真菌多样性之间的相关性 Table 6 The correlation between soil properties and AM fungi species diversity |
植物根围AM真菌多样性指标反映了宿主植物与AM真菌之间的亲和力, 从采集的26种常见盐碱植物根围中共分离鉴定出AM真菌5属38种及两个未确定种, 说明松嫩盐碱草地具有丰富的AM真菌资源, 这与张义飞[15]、周伟健[16]等对松嫩平原西部地区AM真菌资源分布的研究结果相似。26种盐碱植物均能与AM真菌形成良好的共生体系, 但不同植物根际土壤的孢子种类、孢子密度、物种丰度、多样性指数、分离频度、相对多度和重要值均有明显差异, 这说明AM真菌与宿主植物形成共生体系时存在一定的偏好性, AM真菌与宿主植物间的亲和程度及二者的相互选择性在一定程度上决定了AM真菌的生存和发育, 这可能与不同植物根细胞对营养成分的种类和需求量不尽相同有关[17]。Tawaraya等[18]发现, 宿主植物种类和根系结构特征是AM真菌共生与繁殖的重要因素, 宿主植物不同, AM真菌种类、多样性也随之变化。
26种盐碱植物根际土壤AM真菌孢子的分离频度、相对多度和重要值总体上的趋势表现为球囊霉属> 无梗囊霉属> 盾巨孢囊霉属> 巨孢囊霉属> 和平囊霉属, 其中球囊霉属和无梗囊霉属在不同植物中均占绝对优势, 这个研究结果与球囊霉属和无梗囊霉属是广谱共生系统真菌的观点符合[19]。Joniper和Abbott[20]发现, 不同AM真菌对盐胁迫的耐受力不同, 盐碱对根内球囊霉和地表球囊霉的影响较小, 但对美丽盾巨孢囊霉和光壁无梗囊霉孢子的萌发及芽管伸长有一定程度的抑制[20]。根内球囊霉和地表球囊霉是研究区共同的优势菌种, 细凹无梗囊霉和集球囊霉在松嫩盐碱草地分布较多, 是植物根际土中常见菌种, 表明这几种AM真菌对盐碱环境的适应力相对较强, 同时与26种植物均表现出较好的亲和力, 可作为松嫩盐碱草地筛选优势菌种的依据。
Christopher等[21]研究证实, 土壤因子通过作用于宿主植物从而间接影响AM真菌的生长、繁殖及生态分布。从表6可知, 孢子密度和物种丰度与土壤有机质和全氮量均表现为极显著正相关(P< 0.01), 与全磷量表现为显著性正相关(P< 0.05)。这是因为AM真菌能促进宿主植物对土壤中N
本研究结果表明, 在分离鉴定出的5属38种AM真菌中, 球囊霉属是研究区的优势属, 无梗囊霉属为常见属, 由此可见, 二者对盐碱环境有较强的耐受力; 而巨孢囊霉属和盾巨孢囊霉属所占的比例较少, 是研究区的稀有属, 这与张美庆等[19]对我国北方农田土壤AM真菌生态分布的研究结果相似。
从研究结果可知, 肇东地区松嫩平原盐碱植物根际土中AM 真菌资源十分丰富。根内球囊霉和地表球囊霉是不同采样区域的共同优势菌种, 而集球囊霉和缩球囊霉也高频率地出现在不同的植物根际, 这说明同一样地同一宿主植物可以同时被多种AM真菌侵染, 不同样地同一菌种在同一宿主植物上出现的频度也可能存在差异[31], 以上研究结果为进一步探究松嫩平原AM真菌的多样性提供了依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|