第一作者:赵景龙(1989-),男,河南开封人,在读硕士生,主要从事园林植物培育与应用研究。E-mail: [email protected]
为研究早开堇菜( Violaprionantha)对镉(Cd)的耐性及其对Cd的富集特征,使用盆栽方法对早开堇菜进行不同浓度水平Cd处理。结果表明,低浓度Cd(≤10mg·kg-1)促进早开堇菜的生长。当Cd浓度为5mg·kg-1时,早开堇菜植株地下部分、地上部分生物量显著高于对照( P<0.05),达到最大。随Cd处理浓度的升高,其叶绿素含量逐渐下降,超氧化物歧化酶(SOD)、抗氧化物酶(POD)、过氧化氢酶(CAT)活性先升高后降低,丙二醛(MDA)含量则先下降后上升。当Cd处理浓度≤10mg·kg-1时,SOD、POD、CAT表现出较高的活性,与对照无Cd处理相比,MDA含量未显著增加( P>0.05),叶绿素合成也未受到显著抑制,说明早开堇菜对Cd污染有较强的耐性。本研究中,早开堇菜对Cd的富集系数和转运系数均大于1.0。当Cd处理浓度为5mg·kg-1时,早开堇菜植株地上部Cd含量为113.083mg·kg-1,达到了Cd超富集植物的筛选标准。因此,早开堇菜在修复Cd污染土壤方面具有一定的潜在应用价值。
In order to study the physiological effects of cadmium (Cd) on Violaprionantha, the responses of growth and enrichment characteristics of V.prionantha to the Cd were evaluated. The results showed that the growth of plants was promoted under the low Cd concentration (≤10 mg·kg-1), and the biomass of root and shoot of the plants exposed to Cd significantly increased ( P<0.05) when compared to the controls which reached the peaks when the Cd concentration was 5 mg·kg-1. With the increase of Cd concentration, the chlorophyll content decreased, the activities of SOD, POD, CAT all increased firstly and then decreased, whereas, the MDA content decreased firstly and then increased. The activities of SOD, POD and CAT were higher than those of the control, while the contents of MDA and the chlorophyll did not change in the leaves compared to those in the control at concentration of 10 mg·kg-1 Cd treatments. On the other hand, the bioaccumulation and translocation of V.prionantha to Cd were more than 1.0, which confirmed the standard of Cd hyperaccumulator. Therefore V.prionantha can be classified into the Cd hyperaccumulator plants. The above results suggested that V.prionantha can be applied to purify contaminated environment which not only remedied contaminated environments but also bring landscape effects.
镉(Cd)是重金属污染“ 五毒” 之一, 严重污染土壤和水体, 对人类健康和生态系统危害巨大[1]。研究表明, 受Cd毒害的植物, 其细胞膜透性、光合作用、呼吸作用、酶代谢及遗传效应发生改变, 表现出褪绿、生长缓慢、生物量下降等中毒症状[2, 3, 4, 5]。21世纪以来, 随着社会经济的迅速发展和城市化进程的加快, Cd在城市土壤中大量积累, 如何有效治理城市土壤Cd污染, 迫在眉睫[6]。植物修复技术(Phytoremediation)因能维持土壤原有理化性质, 无二次污染而广受关注[7, 8]。但目前发现的Cd超富集植物, 如龙葵(Solanumnigrum)、三叶鬼针草(Bidenspilosa)、球果蔊菜(Rorippaglobosa)、东南景天(Sedumalfredii)、圆锥南芥(Arabispaniculata)等, 大多观赏价值低, 不宜在城市中大面积应用。因此, 筛选具有较高观赏价值的Cd超富集地被植物意义重大。
早开堇菜(Violaprionantha)是堇菜科堇菜属多年生草本植物, 花色艳丽、耐密植、适应性强, 是极具开发价值的乡土型早春观花地被植物[9, 10]。笔者在研究镉胁迫对欧美杂交杨(Populusdeltoids× P.nigra)的毒害作用时, 意外发现盆中有意保留的早开堇菜, 对Cd表现出了较高的耐性。然而目前对堇菜属植物Cd富集特征的研究多集中于同属Cd超富集植物宝山堇菜(V.baoshanensis)[11, 12], 对早开堇菜Cd富集能力的研究尚未见报道。若早开堇菜确实能对Cd表现出较好的耐性, 加之已有学者建立了早开堇菜组织培养快繁体系[13], 意味着早开堇菜在植物修复镉污染方面将具有广泛的应用前景。故本研究拟采用盆栽试验, 旨在探讨:1)Cd胁迫下早开堇菜的耐性, 包括形态及生理响应; 2)早开堇菜对Cd的富集特征。
试验材料为生长健壮、长势一致的早开堇菜二年生苗。供试土壤为取自四川农业大学农场试验基地的水稻土, 其理化性质为pH值5.8、有机质13.87g· kg-1、全氮0.65g· kg-1、全磷0.31g· kg-1、全钾2.43g· kg-1、水解氮47.41g· kg-1、速效磷18.64g· kg-1、速效钾47.15g· kg-1、Cd含量0.17mg· kg-1。供试镉离子来源于分析纯化学试剂CdCl2· 2.5H2O。
盆栽试验于四川农业大学温室大棚中进行。将供试土壤自然风干, 磨碎过4mm筛, 每盆1.0kg, 与一定量的重金属混匀后, 装入内径11cm、高10cm的塑料盆中, 盆下附一托盘, 确保重金属无淋溶损失。试验共设7个浓度处理, 分别为CK(0)、1、5、10、20、50和100mg· kg-1, 以CdCl2· 2.5H2O的形式加入, 每个处理6次重复。平衡4周后, 选择生长健壮、长势一致的早开堇菜二年生苗移栽入盆, 每盆3株, 共42盆。植株生长60d后进行各项指标的测定, 生长期间不定期浇水(水中未检测出Cd), 使土壤含水量经常保持在田间持水量的80%左右。
Cd处理60d后, 取新鲜、成熟叶片, 测定各项生理生化指标, 叶绿素含量采用Lichtenthaler[14]的方法; 超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的测定分别参照李合生[15]、熊庆娥[16]和Carmak和Marschner[17]的方法; 丙二醛(MDA)含量的测定采用李合生[15]的方法。
生物量的测定:将对照和各处理早开堇菜地上和地下部分分别用自来水冲洗, 去除杂物, 再用去离子水洗净, 105℃下杀青30min, 65℃下烘至恒重后称重。
植物、土壤中Cd含量的测定:取各处理及对照植株的地上和地下部分, 用双蒸水冲洗3次, 80℃烘干后用研钵研成粉末备用。试验中所有样品(植株和土壤)中的Cd含量分析采用HNO3-H2SO4-HClO4消解, 电感耦合等离子体发射光谱仪(ICP-OES, OPTIMA2000A, 美国)测定[18]。
采用统计分析软件SPSS17.0和LSD法进行方差分析和差异显著性检验, 用Origin9.0绘制相关图表。
不同处理间及处理与对照之间, 早开堇菜生物量呈现出显著差异(P< 0.05)(表1)。当Cd处理浓度为1、5、10mg· kg-1时, 早开堇菜地下部分、地上部分及整株生物量分别比对照增加了15.31%~30.04%、16.15%~32.07%和15.52%~30.56%; 其中当Cd处理浓度为5mg· kg-1时, 各部分生物量达到最大。然而, 随着Cd处理浓度的进一步增加, 早开堇菜的生长发育逐渐受到抑制, 在Cd处理浓度达到100mg· kg-1时, 其地下部分、地上部分及整株生物量分别比对照降低了46.58%、57.01%、49.27%。该结果表明, 早开堇菜对Cd胁迫表现出较高的耐性, 能够忍受土壤Cd胁迫的浓度介于10~20mg· kg-1。
| 表1 不同Cd处理对早开堇菜植株生物量的影响 Table1 Effects of Cd treatments on biomass ofV.prionantha |
当Cd处理浓度为1、5、10mg· kg-1时, 与对照相比, 早开堇菜叶绿素含量有所增加, 其中叶绿素a的含量显著增加(P< 0.05)(表2)。随着Cd处理浓度的进一步增加, 叶绿素a、叶绿素b、叶绿素a/b均显著降低(P< 0.05); 叶绿素a也更为敏感, 在Cd处理浓度为20mg· kg-1时已显著降低(P< 0.05), 这表明低浓度的Cd在一定程度上促进早开堇菜叶绿素的合成, 而高浓度则表现为抑制。
| 表2 不同Cd处理对早开堇菜叶绿素含量的影响 Table2 Effects of Cd treatments on chlorophyll content in the leaves ofV.prionantha |
SOD、POD和CAT酶活性随Cd处理浓度的增加先升高后降低, 且均在5mg· kg-1时活性达到最大(表3)。随着Cd处理浓度的进一步增加, SOD和POD酶活性显著降低(P< 0.05); CAT酶活性则持续表现较高活性, 至Cd处理浓度达到100mg· kg-1时显著低于对照(P< 0.05)。
| 表3 不同Cd处理对早开堇菜叶片抗氧化酶活性及丙二醛含量的影响 Table3 EffectsofCdtreatmentsontheactivityofSOD, POD, CATandthecontentofMDAofV.prionantha |
MDA作为膜脂过氧化的重要产物, 其含量则随Cd处理浓度的增加先降低后升高, 与抗氧化酶活性变化的趋势相反。当抗氧化酶活性最大, 即Cd处理浓度为5mg· kg-1时, MDA含量最低, Cd浓度≥ 20mg· kg-1时显著高于对照(P< 0.05)。
以上结果表明, Cd处理达到一定浓度时会显著抑制早开堇菜叶片中的各抗氧化酶活性, 打破体内原有的自由基代谢平衡, 对细胞膜系统造成显著的氧化伤害。
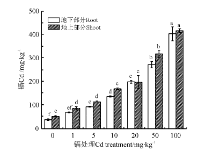
不同浓度Cd处理对早开堇菜体内Cd含量的影响(图1), 通过一元线性回归分析可得地下部分回归方程为y=81.678+3.404x, R2=0.942(P< 0.05), 地上部分回归方程为y=101.071+3.431x, R2=0.928(P< 0.05)。早开堇菜地上部分和地下部分的Cd含量均随Cd处理浓度的升高呈现显著的线性增加趋势。镉胁迫60d后测定发现, Cd处理浓度为5mg· kg-1时, 早开堇菜生物量最大(表1), 此时地上部分Cd含量为113.083mg· kg-1, 超过了Cd超富集植物临界含量标准(100mg· kg-1)[19]。
富集系数(Bioaccumulationfactor, BF)作为反映植物将培养基质中某重金属元素通过吸收转移到体内能力大小的评价指标, 是指植物体中某重金属元素含量与培养基质中该元素含量之比, 表征培养基质-植物体系中元素迁移的难易程度, 即富集系数越高, 说明植物吸收该重金属元素能力越强[19]。早开堇菜对Cd的富集系数随Cd浓度的增加而下降(表4), 地下部分富集系数介于4.016~68.761, 地上部富集系数介于4.144~85.810, 均大于1.0, 达到了Cd超富集植物富集系数应大于1.0的标准[19]。
转运系数(Translocationfactor, TF)作为反映植物将某重金属元素从地下向地上运输的能力, 是地上部与地下部该元素含量的比值, 转运系数越大, 说明该重金属通过根系向地上部器官的转移能力越强[19]。早开堇菜对Cd的转移系数介于0.992~1.369(表4), 大多数浓度处理下具备了Cd超富集植物转移系数大于1.0的特征[19]。与早开堇菜Cd富集系数一样, 转运系数也随Cd处理浓度的增加而下降, 说明高浓度的Cd不仅会抑制植物对Cd的吸收和积累, Cd由地下向地上部器官的转运能力也会受到抑制。
| 表4 不同Cd处理对早开堇菜富集转运特性的影响 Table4 EffectsofCdtreatmentsontheandbioaccumulation(BF)andtranslocation(TF)ofV.prionantha |
叶绿素作为植物光合作用的物质基础, 其含量的变化直接影响光合作用的强弱, 决定植物生物量的高低, 从而反映植物对Cd的耐性[20]。大多数研究表明, Cd胁迫会降低叶绿素含量, 破坏叶绿体结构, 严重影响植物生长[2, 3, 4, 5, 21, 22]。但很多研究也表明, 低浓度的Cd对植物叶绿素合成及生长有一定的促进作用。刘爱中等[23]发现当Cd浓度低于5mg· kg-1时, 龙须草(Eulaliopsisbinata)的叶绿素含量、净光合速率、生物量均显著高于对照(P< 0.05); Li等[24]的研究也表明, 与对照(Cd浓度为0μ mol· L-1)相比, 5~30μ mol· L-1的Cd胁迫下紫花香薷(Elsholfiziaargyi)的净光合速率显著升高(P< 0.05)。本研究与上述研究结果一致, 低浓度Cd(≤ 10mg· kg-1)对早开堇菜叶绿素合成及生长表现出一定的促进作用。该结果可能与Cd影响植物矿质营养吸收和分配有关。研究表明, 低浓度的Cd会促进植物对Mg、P、Fe、Cu、Zn的吸收[25, 26, 27], 其中Mg是叶绿素分子的重要组成部分[28], P、Fe、Cu、Zn在叶绿素形成中有一定的催化作用[28], Cu又是光合反应中电子从PSⅡ 传递至PSⅠ 的关键蛋白-质体蓝素的主要组成元素[29], 故低浓度的Cd会促进叶绿素的合成, 增强光合作用, 促进植物生长。此外, 低浓度的Cd还会促进植物生长型激素IAA和GA3的合成, 且使IAA/ABA值升高, 从而促进植物生长[30, 31]。但低浓度Cd促进植物叶绿素合成及生长的机制仍需进一步探讨。
研究表明, 重金属对植物的毒害与植物体内活性氧自由基的积累关系密切[32, 33]。正常情况下, 植物体内的抗氧化防御系统能够及时清除体内的活性氧自由基和过氧化物, 维持自由基代谢的动态平衡, 而重金属胁迫打破了该平衡, 使得活性氧大量积累, 造成膜脂过氧化, 细胞膜的结构和功能遭到破坏, 植物生长异常。SOD、POD和CAT在维持该动态平衡, 减少活性氧对植物的伤害中发挥着重要作用[34]。然而, 重金属胁迫下, 不同植物的抗氧化系统清除活性氧的能力差别较大, 如Sun等[35]的研究表明, Cd胁迫下Cd超富集植物龙葵的SOD、POD活性显著高于同属非超富集植物茄子(Solanummelongenal); 田治国和王飞[36]研究发现, 不同品种万寿菊(Tageteserecta)的Cd耐性和抗氧化酶活性也存在很大差异。因此, 重金属胁迫下, SOD、POD、CAT等抗氧化酶活性的变化在某种程度上可以衡量植物对重金属的耐性。在本研究中, 随Cd处理浓度的升高, 早开堇菜的SOD、POD、CAT酶活性呈现先升高后降低的趋势, 符合植物对胁迫反应的典型防御特征; Cd浓度为5mg· kg-1时各抗氧化活酶性最大, 超过20mg· kg-1时抗氧化酶活性、叶绿素含量、生物量显著低于对照, MDA含量也显著增加, 说明早开堇菜在土壤中Cd浓度低于20mg· kg-1时具有较强的耐性, 表现出了超富集植物基本的耐性特征。
Baker[37]依据植物吸收、转移、积累重金属的机制, 将植物划分为积累型(超积累型)、指示型(敏感性)和排斥型, 也就是说对重金属有很强耐性的植物并不一定是超富集植物, 例如短穗柽柳(Tamarixlaxa)、芦苇(Phragmitesaustralis)主要通过根部截留, 减少Cd向地上部的转移从而降低Cd毒害, 属于排斥型[38, 39], 菖蒲(Acoruscalamus)对铬(Cr)表现出很好的吸收和转运能力, 属于积累型[40]。因此, 是否为超富集植物主要依据植物体内, 尤其是地上部能否积累大量的重金属, 且重金属富集系数和转运系数应大于1.0。本研究结果表明, 早开堇菜地下部富集系数平均为20.012, 地上部富集系数平均为24.261, 转移系数平均为1.182, 达到了Cd超富集植物的基本要求。
综合本研究表明, 早开堇菜在低浓度Cd(≤ 10mg· kg-1)胁迫下, 叶绿素合成未受抑制, 生长反而增强, 对Cd污染表现出了较高的耐性; 早开堇菜对Cd的富集系数和转运系数均大于1, 达到了Cd超富集植物的标准; 且早开堇菜地理分布广泛、抗逆性强、生长迅速、耐密植, 在修复Cd污染土壤的同时能够增强景观效果。因此, 早开堇菜在Cd污染土壤的修复中有很大的应用潜力。
(责任编辑 王芳)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|