第一作者:周璐璐(1990-),女,河北沧州人,在读硕士生,主要从事牧草种质资源和遗传育种研究。Email:[email protected]
为提高沙芦草( Agropyron mongolicum)的牧草品质,筛选最优的染色体加倍方案,采用不同浓度的秋水仙素(0.02%,0.05%,0.08%,0.11%,0.14%+1.5%二甲基亚枫)和氟乐灵(1,5,10,15,20 μmol·L-1)处理沙芦草种子,并进行表观形态及染色体数目的鉴定。结果表明,经处理的沙芦草种子成活后的变异植株均为二倍体与四倍体的混倍体;0.11%秋水仙素+1.5%二甲基亚砜处理20 h的染色体数目变异率最大,高达50%,其成活率为40%;1 μmol·L-1氟乐灵处理6 h变异效果显著,变异率达38.46%。本研究为后期进一步筛选沙芦草加倍植株奠定了理论与试验基础。
In order to improve the forage quality of Agropyron mongolicum and screen the best chromosome doubling treatment, the seeds of A. mongolicum were treated with different concentrations of Colchicine (0.02%,0.05%,0.08%,0.11%,0.14%+1.5% DMSO) and Trifluralin (1,5,10,15,20 μmol·L-1) and the morphology and chromosome number were identified after treatment. The results showed that the surviving plants after treated were mixoploid of diploid and tetraploid. The treatment with 0.11% colchicine 1.5% DMSO for 20 h had the highest mutation rate of 50% and the survival rate of 40%. The treatment with 1 μmol·L-1 trifluralin for 6 h had significant mutation effect with probability of 38.46%. These results provide theoretical and experimental basis for further screening the chromosome doubling plants of A. mongolicum.
沙芦草(Agropyron mongolicum)又称蒙古冰草, 为禾本科(Gramineae)小麦族冰草属多年生草本植物, 主要分布于我国中西部的荒漠草原, 具有抗旱、抗寒、耐风沙、耐贫瘠等特性, 青绿持续期长, 适口性好, 营养成分含量较高[1], 具有重要饲用价值、生态价值和遗传价值。我国学者在沙芦草的分类学历史、植物学特征、生物学特征、经济价值以及遗传育种学和栽培学等方面进行了研究[2, 3, 4, 5, 6, 7, 8], 并通过人工野生驯化和混合选择, 成功培育出内蒙沙芦草(A. mongolicum cv. Neimeng)和蒙农1号蒙古冰草(A. mongolicum cv. Mengnong No.1)两个沙芦草新品种[9]; 于肖夏等[10]利用秋水仙素对二倍体航道冰草(A. cristatum cv. Fairway)与沙芦草杂交的F1代种子进行染色体加倍诱导, 并选育得到四倍体杂交冰草优良新品系SZB-02。
沙芦草是异交率很高的二倍体(2n=2x=14)植物, 其叶量少、产草量相对较低, 严重影响其经济效益。经过染色体加倍的植物一般具有植株巨大性、抗逆性强、营养成分丰富等特性[11], 因此考虑利用倍性育种方法, 培育产草量较高的沙芦草新品种。许多研究表明, 在化学诱变染色体加倍过程中的诱变剂类型、诱变剂浓度、处理时间以及处理时期是影响植物染色体加倍效果的主要因素[12, 13], 因此, 探索最佳的沙芦草染色体加倍条件对多倍体沙芦草的培育具有重要意义。本研究对沙芦草染色体加倍诱变剂种类、诱变剂浓度以及处理时间进行研究, 旨在筛选出最佳的沙芦草染色体加倍条件, 为沙芦草四倍体培育提供理论基础。
2014年于银川市宁夏大学南场实训基地采集的沙芦草种子。
1.2.1 种子消毒 用75%酒精浸泡种子1 min, 再用0.1% HgCl2浸泡10 min, 最后用无菌水漂洗3次。
1.2.2 染色体加倍处理 1)秋水仙素处理:将种子用清水浸泡12 h, 待胚根刚刚萌发时取出, 用0.02%、0.05%、0.08%、0.11%、0.14%的秋水仙素分别加1.5%二甲基亚砜(DMSO), 在25 ℃下依次浸泡处理6、10、16、20、24 h, 并以蒸馏水浸泡作对照。每个处理3次重复, 每个重复30粒种子。2)氟乐灵处理:用上述同样方法处理种子, 用氟乐灵作加倍诱变剂, 处理浓度分别为1、5、10、15、20 μ mol· L-1, 处理时间依次为6、12、18、24、30 h, 用蒸馏水处理作对照。每个处理3次重复, 每个重复30粒种子。
1.2.3 恢复培养 将处理后的种子用清水彻底清洗, 并分别放入铺有两层滤纸的培养皿中恢复培养, 生长10 d后移植到土壤中继续生长。观察生长状况, 成苗后进行染色体倍性鉴定。
1.3.1 表观形态的鉴定 发芽10 d测量苗高与根长, 并统计发芽率, 观察幼苗形态, 统计形态变异率; 移栽30 d统计成活率和染色体数目变异率。
1.3.2 染色体制片法 1)预处理:取根部, 用0.002 mol· L-1 8-羟基喹啉浸泡4 h; 2)固定:取出根尖放入卡诺固定液中固定12 h; 3)解离:1 mol· L-1的盐酸解离20 min; 4)染色制片:卡宝品红染液染色15~20 min; 5)显微镜下观察染色体数目。
1.3.3 各指标计算方法
发芽率=第10天发芽种子数/供试种子总数× 100%;
形态变异率=形态变异的幼苗数/幼苗总数× 100%;
成活率=30 d成活苗数/移栽苗总数× 100%;
染色体变异率=染色体数目变异苗数/成活苗数× 100%。
运用SAS 9.0和Excel做数据统计及方差分析。
经两种诱变剂的处理, 沙芦草幼苗形态出现不同程度的变异(表1、图1)。萌发初期, 诱变剂使部分细胞染色体加倍, 造成细胞体积增大, 对植物组织的正常生理环境造成破坏, 使芽体表面凹凸不平, 细胞组织疏松变形, 幼苗出现粗化苗、卷化苗和球状苗等变异苗。正常幼苗形态:叶片纤细, 幼根发达细长, 透明乳白色; 粗化苗形态:叶片呈鼓锤状, 颜色深绿, 幼根颜色发黄, 有膨大现象; 卷化苗形态:叶片发生卷曲化, 表面组织疏松, 幼根颜色发黄; 球化苗形态:叶片呈球状, 表面凹凸不平, 幼根粗短褐化。秋水仙素处理的变异幼苗以粗化苗为主, 氟乐灵处理的变异幼苗以球状苗为主。随秋水仙素和氟乐灵的浓度增大和处理时间的延长, 沙芦草形态变异率明显增加, 其中, 0.08%秋水仙素处理24 h、15 μ mol· L-1氟乐灵处理24 h和20 μ mol· L-1处理30 h的变异率较高, 分别为92.31%、56.25%和56.25%。由此可见, 秋水仙素和氟乐灵对沙芦草种子的幼苗生长形态有不同程度的影响。
| 表1 秋水仙素和氟乐灵处理后不同变异苗形态比较统计结果 Table 1 The comparison of different seedlings treated by Colchicine and Trifluralin |
随秋水仙素浓度的升高, 沙芦草发芽率总体呈下降趋势, 以0.05%秋水仙素处理下平均发芽率最高, 为44.67%; 相同秋水仙素浓度处理下, 随处理时间的延长, 发芽率呈下降趋势, 但24 h处理下的种子因浸泡作用使得发芽率在0.05%、0.11%和0.14%水平又有所升高(图2), 各浓度水平短时间处理(6 h)与长时间处理(20 h)发芽率差异显著(P< 0.05)。氟乐灵处理的沙芦草种子发芽率随浓度的升高无规律性变化(图3), 各浓度处理的平均发芽率均低于40%, 其中, 15 μ mol· L-1氟乐灵处理后的沙芦草种子平均发芽率最高, 为33.11%, 且该浓度下不同时间处理之间差异显著(P< 0.05), 1、5、20 μ mol· L-1浓度水平不同时间处理差异不显著(P> 0.05)。
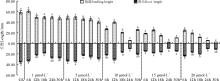
两种诱变剂对沙芦草种子第10天的苗高与根长的生长有抑制作用(图4, 图5), 且秋水仙素的抑制作用大于氟乐灵, 说明秋水仙素毒性更强。随秋水仙素浓度的增大, 第10天平均苗高和根长总体变化较小, 处理24 h的种子, 除0.02%和0.11%水平外, 其他浓度处理苗高均显著减小; 各浓度处理的种子苗高与根长均显著小于对照。经氟乐灵处理的沙芦草种子第10天苗高与根长随浓度的升高均呈下降趋势, 除1 μ mol· L-1的氟乐灵处理6 h的种子苗高和根长大于对照外, 其他各处理水平下的苗高和根长均低于对照, 且浓度越高, 抑制作用越大, 苗高与根长值越小; 1和5 μ mol· L-1浓度下, 不同处理时间苗高与根长的变化较小, 10、15、20 μ mol· L-1浓度下不同处理时间苗高和根长变化较大, 说明浓度越大, 对种子萌发后的生长影响越大。
为判断诱变剂浓度和处理时间单个因素的影响水平和两因素之间的交互作用, 用SAS软件进行方差分析(表3), 结果显示诱变剂的浓度和处理时间对沙芦草的发芽率、苗高与根长有不同程度的影响。秋水仙素的浓度对沙芦草的平均发芽率、苗高和根长无显著影响(P> 0.05), 不同时间处理对平均发芽率、苗高和根长均有极显著影响(P< 0.01), 说明秋水仙素的处理时间是影响发芽率的主要因素, 同时秋水仙素处理浓度和时间对发芽率、苗高和根长的影响存在显著交互作用。不同浓度的氟乐灵和不同处理时间下, 沙芦草发芽率上均不存在显著差异(P> 0.05), 但在苗高和根长上存在极显著差异(P< 0.01); 氟乐灵浓度和时间对发芽率的影响存在交互作用, 但对苗高和根长的影响不存在交互作用。
 | 图4 秋水仙素浓度和处理时间对沙芦草第10天苗高与根长的影响Fig.4 Effects of colchicine’ s concentration and treatment time on seedling and root length of A. mongolicum |
2.5.1 染色体数目鉴定结果 正常二倍体染色体数为2n=14条, 加倍后的染色体数为4n=28条, 但试验结果中没有成功加倍的四倍体, 均为二倍体细胞和四倍体细胞组成的混倍体(图6)。加倍处理后的染色体只在数量上发生了变异, 形态上与正常细胞染色体没有差异。
2.5.2 秋水仙素对沙芦草成活率与染色体变异率的影响 秋水仙素+1.5%二甲基亚砜处理的沙芦草幼苗成活率相对较高, 平均成活率达到63.77%, 0.11%秋水仙素浸种10 h的处理水平成活率最高, 可达到91.43%; 各处理的染色体变异率均较低, 平均变异率仅为13.30%, 0.11%秋水仙素浸种20 h的处理水平变异率最大, 为50.00%, 整体呈现出高浓度的秋水仙素比低浓度的诱导效果更好(表3)。综合考虑成活率和变异率, 0.11%浓度处理20 h的染色体数目变异率最大, 高达50%, 其成活率为40%, 因本试验目的是在不过度影响成活率的基础上得到更高的变异率, 因此可将此处理水平暂定为最佳变异处理水平。
2.5.3 氟乐灵对沙芦草成活率与染色体变异率的影响 氟乐灵处理的种子成活率与变异率变化幅度较大(表3)。随浓度的升高, 成活率总体呈下降趋势, 其中5 μ mol· L-1氟乐灵处理24 h的成活率最高, 可达到86.96%, 20 μ mol· L-1浓度下长时间的处理水平(24和30 h)因其毒害作用过大, 幼苗全部死亡; 氟乐灵各处理的染色体变异率普遍较低, 平均变异率仅为13.05%, 最高变异率为38.46%(1 μ mol· L-1处理30 h)。综合分析成活率与染色体变异率可知:1 μ mol· L-1处理30 h的成活率与变异率都较高, 成活率高达81.25%, 变异率可达38.46%, 初步判断为氟乐灵最佳诱变处理水平。
| 表2 不同诱变剂对沙芦草发芽率、苗高与根长影响的方差分析 Table 2 Variance test of germination rate, seedling height and root length of A. mongolicum under different concentrations of two mutagents |
| 表3 秋水仙素和氟乐灵处理沙芦草种子变异率统计 Table 3 The seed mutation rate statistics of chromosome number of A. mongolicum under colchicine and trifluralin treatment |
本研究用诱变剂处理萌动种子以得到多倍体植株, 因其简单易行, 曾被学者们广泛使用, 并得到不同的加倍效果。秋水仙素和氟乐灵的加倍原理相似, 秋水仙素是与微管蛋白异二聚体结合, 抑制微管装配的一种生物碱[14]; 氟乐灵是一种可以抑制微管形成, 诱变率较高、毒性较小的新型除草剂[15], Stadler等[16]和Wan和Widholm[17]也曾研究证实除草剂对植物细胞具有加倍作用。诱变剂只在细胞分裂时期通过抑制纺锤体的形成导致细胞不分裂, 从而使染色体数目加倍, 对不分裂的成熟细胞没有作用[18], 因此, 在诱发多倍体的过程中, 只是部分细胞加倍, 分生组织中的一层、两层或者所有细胞会受到影响, 继续发育成为一个混倍体或多倍体细胞系[19], 有学者们用秋水仙素处理菘蓝(Isatis indigotica)获得混倍体的加倍植株而非多倍体植株[20]。植物混倍体是不稳定的, 它是繁殖过程中出现的新植株类型[21], 所以混倍体植株是由二倍体诱导四倍体植株加倍成功的标志, 本研究所得植株也均为混倍体植株, 可以为培育沙芦草新品种提供材料基础。
两种试剂相比, 微量氟乐灵就可达到加倍效果, 因此更受到研究者的青睐。同时不同植物对不同试剂浓度与处理时间的敏感度不同, 因此, 要根据不同植物设计不同的处理水平。魏育国和蒋菊芳[22]用400倍的氟乐灵处理萌动的甜瓜(Cucumis melo)种子8 h可使诱变率高达32.2%; 葛志东等[23]用浸种法和生长点滴液法处理西葫芦(Cucurbita pepo)种子, 诱变率可达到20%; 赵晓潘[24]用20 μ mol· L-1氟乐灵溶液处理半枝莲(Scutellaria barbata)枝条, 变异率达到64.7%; 张竞秋等[25]研究发现氟乐灵会使小麦(Triticum aestivum)根尖细胞发生畸变。本研究沙芦草变异植株的统计结果显示:0.11%的秋水仙素+1.5%二甲基亚砜处理20 h的染色体数目变异率最大, 高达50%, 其成活率为40%; 1 μ mol· L-1的氟乐灵处理30 h的成活率与变异率都较高, 成活率高达81.25%, 染色体数目变异率可达38.46%, 因此可以初步确定为最佳处理水平。
此外, 通过对发芽率、苗高与根长以及成活率的综合统计分析, 发现两种诱变剂主要抑制沙芦草的生长, 但所抑制的阶段有所不同, 秋水仙素主要抑制种子的萌发及初期的伸长生长, 表现为发芽率低, 苗高与根长值相对较小; 而氟乐灵显著降低后期的成活率, 其原因有待进一步进行生理生化试验来证实。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|