第一作者:夏方山(1983-),男,山东安丘人,博士,研究方向为草类植物育种与种子科学。E-mail:[email protected]
种子老化是影响种子贮藏的关键问题。活性氧(reactive oxygen species,ROS)非酶促清除剂能延缓种子的老化,但其含量会因种子老化而下降。因此,合理添加ROS非酶促清除剂协助其内部酶系统共同清除种子内ROS,抑制种子的老化,从而延长种子的贮藏寿命,这将成为种质资源迁地保存研究的一个必然发展趋势。本文重点综述了ROS非酶促清除剂的种类及其对种子老化过程的影响,并系统分析了ROS非酶促清除剂在种子老化过程中的研究现状、存在问题及其研究前景,以期为研究种子老化过程中ROS非酶促清除剂的作用机理提供理论基础。
Seed ageing was the pivotal problem to influence their storage, which could be delayed by the non-enzymatic scavenging agents of reactive oxygen species (ROS). However, the content of non-enzymatic scavenging agents reduced during seed ageing. Therefore, it was necessary that non-enzymatic scavenging agents were applied to extend the life span in seeds by eliminating ROS during storage, which would be an inevitable development tendency in ex-situ conservation of germplasm resources. This papermainly reviewed the types and their influences of non-enzymatic scavenging agents on aged seeds, and systematically analyzed their research status, existing problems, and future prospects during seed ageing. This paper might provide a theoretical foundation to study the mechanism of non-enzymatic scavenging agents during seed ageing.
种子在发育形成及贮藏过程中不断地进行有氧代谢, 并产生各种有害的活性氧(reactive oxygen species, ROS)。同时, 种子内广泛存在着各种活性物质, 通过终止自由基链式反应而清除ROS, 以确保细胞内ROS维持平衡水平, 使其免受伤害, 它们在种子发育、贮藏及萌发过程中发挥着不可缺少的作用。ROS一旦过量积累就会攻击膜上的不饱和脂肪酸, 诱导脂质过氧化作用(lipid peroxidation, LPO), 从而抑制机体内ROS清除剂的形成及功能发挥, 造成种子内ROS积累与清除剂之间的失衡, 使机体清除ROS的能力下降, 致使细胞LPO增强, 最终导致贮藏条件下种子的老化, 表现为丙二醛(malondialdehyde, MDA)含量显著升高, 甚至造成种子内部酶蛋白失活、DNA损伤, 诱导细胞程序性死亡等, 这是造成种子活力丧失的合理解释之一(图1)[1, 2, 3, 4, 5, 6, 7]。这一结论已在圣栎(Quercus ilex)[8]、向日葵(Helianthus annuus)[9-10]、麻疯树(Jatropha curcas)[11]、老芒麦(Elymus sibiricus)[12]、大豆(Glycine max)[13]、菊苣(Cichoriun intybus)[14]、榆树(Ulmus pumila)[15]、羊草(Leymus chinensis)[16]及结缕草(Zoysia japonica)[17]等大量植物种子老化研究中得到证实。所以, 探讨种子老化过程中内源ROS清除剂与种子活力之间的关系, 并采用适宜种类与浓度的外源ROS清除剂, 调节种子老化过程中ROS的产生与清除之间的平衡, 提高种子活力水平, 延缓或修复种子老化产生的伤害, 对农牧业生产具有较高的理论和应用价值。
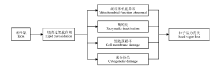 | 图1 活性氧对种子的老化损伤[1, 2, 3, 4, 5, 6, 7]Fig.1 The damage of reactive oxygen species during seed ageing[1, 2, 3, 4, 5, 6, 7] |
种子已经进化出一个复杂的ROS清除系统来保护细胞膜和细胞器, 使其免受ROS的损伤, 除了众所周知的酶系统, 还有一个未完全阐明的ROS非酶促清除系统[3, 18]。前者主要包括超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD)、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)、谷胱甘肽还原酶(glutathione reductase, GR)、单脱氢抗坏血酸还原酶(monodehydroascorbate reductase, MDHAR)及脱氢抗坏血酸还原酶(dehydroascorbate reductase, DHAR)等[19, 20, 21], 后者主要包括抗坏血酸(ascorbic acid, AsA)、维生素E(vitamin E, VE)、谷胱甘肽(glutathione, GSH)、类胡萝卜素(carotenoids)、硒(Selenium, Se)、水杨酸(salicylic acid, SA)、茉莉酸(jasmonic acid, JA)和多酚类(polyphenols)等[21, 22, 23, 24]。老化种子内ROS的清除, 需要依赖内部酶促和非酶促清除剂之间的相互调节与平衡, 因此, 适当添加外源ROS非酶促清除剂, 可以共同完成对ROS积累的解毒作用, 延缓或修复种子的老化损伤。
AsA是生命体内普遍存在的最重要的小分子活性物质, 也是体内许多物质代谢和氧化还原反应的重要参与者之一[25]。AsA生物功能的完成与其氧化还原状态以及生物合成、代谢、再生和转运相关酶类活性的变化密切相关, 在植物种子抵抗氧化胁迫、提高种子活力、促进细胞分裂和伸长中发挥着重要作用[7, 26]。通过研究榆树[15]、大豆[24]、甘菊(Matricaria recutita)[21]、茄子(Solanum melongena)[27-28]、棉花(Gossypium hirsutum)[29]、银白槭(Acer saccharinum)[30]及小麦(Triticum aestivum)[31]等植物种子的老化发现, AsA不仅能有效降低H2O2等ROS的含量, 还能显著增强种子内CAT、APX、GR、SOD及POD等抗氧化酶的活性, 与其协同抑制种子LPO的发生, 这表现为浸出液中电解质外渗量及MDA含量减少。老化的水稻(Oryza sativa)种子中AsA含量减少, APX和MDHAR活性降低, 同时基因APX1和MDHAR1表达下调[32]。AsA对老化产生的伤害具有明显的防护或修复作用, 可能因其在APX的作用下, 易被种子内的、1O2或H2O2氧化, 生成脱氢抗坏血酸(dehydroascorbate, DHA), 从而直接清除种子内ROS的伤害, 抑制了LPO[33, 34]; 也可能AsA与GSH相偶联, 与APX、GR、MDHAR和DHAR等酶促ROS清除剂相互作用, 通过AsA-GSH循环来清除种子细胞内过量积累的H2O2(图2)[19, 26]。同时, AsA可以促进细胞色素c的生成, 激活细胞凋亡蛋白酶3的活性, 从而延缓细胞的程序性凋亡。另外, 可能AsA协调或改善了老化种子内部的生理代谢过程, 促进了被损伤细胞膜结构的修复, 提高了物质转化速率, 增强了幼苗的光合同化能力, 从而表现为延缓或修复了种子的老化损伤。
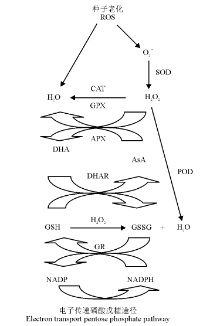 | 图2 种子老化过程中以H2O2为中心的ROS清除途径[19, 26]Fig.2 ROS scavenging pathways centered with H2O2 in seed ageing[19, 26] 注:APX, 抗坏血酸过氧化物酶; AsA, 抗坏血酸; CAT, 过氧化氢酶; DHA, 脱氢抗坏血酸; DHAR, 脱氢抗坏血酸还原酶; GPX, 谷胱甘肽过氧化物酶; GR, 谷胱甘肽还原酶; GSH, 谷胱甘肽; GSSG, 氧化型谷胱甘肽; POD, 过氧化物酶; SOD, 超氧化物歧化酶。 Note:APX, ascorbate peroxidase; AsA, ascorbic acid; CAT, catalase; DHA, dehydroascorbate; DHAR, dehydroascorbate reductase; GPX, glutathione peroxidase; GR, glutathione reductase; GSH, glutathione; GSSG, oxidized glutathione; POD, peroxidase; SOD, superoxide dismutase. |
AsA与种子活力的关系因植物种类和处理方式不同而异。温度和水分导致贮藏山毛榉(Fagus sylvatica)种子丧失活力时, AsA含量显著增加, 而不同贮藏年龄的山毛榉种子活力降低时, AsA含量显著下降[7, 26]。前者AsA含量增加, 可能是由于种子呼吸作用的增强或者是分解酶活性降低引起的, 而后者减少可能是AsA参与了种子内ROS的清除反应。种胚线粒体AsA含量与不同老化时间的燕麦(Avena sativa)种子发芽率呈正相关[35], 但AsA含量的变化与贮藏期间的银杏(Ginkgo biloba)种子的发芽能力并不完全相关[36], 种子内AsA的积累, 除了其清除ROS的积极功能外, 可能还具有负面影响, 尤其在水分亏缺条件下, AsA更可能与Fe2+反应, 释放出OH· 自由基[26, 37]。
尽管AsA能有效清除种子老化过程中产生的ROS, 但其数量和有效性不能完全猝灭ROS, AsA不能阻止种子老化的发生[24]。另外, 虽然AsA含量在种子萌发过程中会增加[38], 仍不能完全弥补其在老化过程中的损耗。因此, 添加外源AsA来延缓或者修复种子的老化也就成为必然, 但外源AsA处理对老化种子的作用效果, 与其浓度关系密切, 而且是否具有双重效应尚有待于进一步研究。2.5% AsA处理能够有效提高人工加速老化的向日葵种子发芽率及芽长, 但5%的AsA处理对其没有影响[39], 这说明AsA含量维持在一定的浓度范围是延缓种子老化损伤的关键, 一旦过量就会加剧种子的老化损伤。但在同一老化处理时间下, 高浓度AsA会降低小麦种子的脂质过氧化产物MDA的含量, 增强老化种子的活力, 其效应更显著[31]。研究发现, 外源AsA对老化种子的修复作用主要依赖于线粒体APX和MDHAR来完成[40]。
GSH作为细胞的ROS清除剂, 不仅能保护含硫醇的酶, 还能直接清除ROS, 因此, GSH的含量水平及其相关酶活性常被作为机体清除ROS状态的标志[41]。然而, 目前关于GSH对种子老化的作用尚未统一, 即使认为GSH对老化种子具有修复作用, 但其机理也存在一定的争议。一般认为, 在干燥或成熟的正常种子中, AsA含量会缺乏, GSH则易被维持, 而在种子老化过程中却存在差异[37, 42]。GSH与贮藏后的山毛榉老化种子的发芽率不相关[7], 但伴随着种子活力的丧失, 银杏种子GSH含量减少, 发生在种子贮藏期间的GSH代谢的改变, 可能参与了种子发芽势的下降[36]。研究老化大麦(Hordeum vulgare)种子发现, 水溶性GSH及其相关的硫醇通过转变为二硫化物而提供一个强大的细胞内氧化环境[43]。GSH处理既可以提高人工加速老化的向日葵种子的发芽率, 还能显著促进正常幼苗的生长[39]。研究表明, GSH处理有利于老化种子修复, 既可能直接与ROS反应, 也可能通过AsA-GSH循环间接清除ROS, 从而清除种子老化过程产生的过量ROS, 使细胞膜免受ROS攻击, 延缓种子的LPO进程(图2)[19, 26]。外源GSH对老化种子的修复主要通过线粒体GR和DHAR协同完成[40]。De-Vos等[6]认为, 在种子老化引起的氧化应激过程中, GSH被氧化成了氧化型(GSSG), 但这并不影响其吸收GSSG的还原能力, 且成熟种子发芽率的降低, 并不能直接归因于GSH的减少。Kranner等[42]和Seal等[44]则认为, 无论是GSH浓度还是GSSG浓度均不单独与种子活力相关, 而GSH还原电位(EGSSG/2GSH)与贮藏期间种子活力有很强的相关性, 并在种子活力丧失前增加, 因此, EGSSG/2GSH是种子活力丧失或VE含量变化的一个早期预警系统, 被认为是一个可靠的评价种子活力的生化指标。这些研究争议可能既与植物品种有关, 又与老化条件之间的差异有关[45]。鉴于对上述研究的分析认为, GSH在种子老化过程中的代谢途径、作用效果以及与ROS酶促清除剂之间相互作用的生理及分子机制, 将是该领域进一步研究探讨的重点和难点。
VE作为一种小分子脂溶性ROS清除剂, 具有保护种子细胞膜免受ROS伤害的作用, 它的主要功能是在种子老化过程中限制非酶促LPO的发生[7, 44]。但长期以来, VE对种子老化的影响也一直存在争议, 甚至在同一物种的相关研究中。Sattler等[46]研究缺乏天然VE合成的拟南芥(Arabidopsis thaliana)突变体种子发现, VE是植物种子长寿必不可少的物质。而老化过程降低了VE的含量及其相关酶对氧化攻击的保护作用, 直接导致了ROS的积累和LPO的发生, 最终造成了种子活力的降低。这在萝卜(Raphanus sativus)[3]、挪威枫(Acer platanoides)[47]、蚕豆(Vicia faba)[48]、大豆[49-50]、油菜(Brassica napus)[51]、山毛榉[7, 52-53]、夏栎(Quercus robur)[54]、樟子松(Pinus sylvestris)[55]及芝麻(Sesamum indicum)[56]等植物种子的老化中被验证, 并发现VE含量会随种子老化程度的加深而逐渐减少, 自然老化比人工加速老化处理条件下降幅度大。天然VE含量会随其降解或合成相关基因表达的变化而发生变化, 通过降低ROS的积累(尤其是H2O2、和HO· ), 抑制LPO的进行, 从而阻止氧化损伤, 实现对种子的保护作用[57]。一些研究表明, 金合欢树(Acacia bivenosa)[58]、袋鼠花(Anigozanthos manglesii)[58]、橙色山龙眼(Banksia ashbyi)[58]及大豆[59]种子内VE含量与其活力没有任何相关性, 但另一些研究对埃及榕(Acer pseudoplatanus)[60]、挪威槭[60]和大豆[61]等植物种子的老化研究则发现, VE的含量随种子活力的降低而增加, 这说明VE含量对种子老化没有影响。外源VE对老化种子的影响也同样存在争议。与对照相比, VE处理不仅能提高人工加速老化的向日葵种子发芽率, 还能显著提高其正常幼苗的芽长[39]。而豌豆(Pisum sativum)种子自然老化的前期, 外源VE处理没有表现出有利作用, 后期则有延缓劣变的作用, 但与自然老化所不同的是, VE对人工老化豌豆种子的劣变没有明显的减缓作用[62]。
VE对种子老化的影响存在差异的原因是多方面的, 可能是植物种类不同所致。植物体内VE共有4种自然存在形式, 分别为α -生育酚、γ -生育酚、β -生育酚及δ -生育酚, 而α -生育酚是天然VE中自由基清除活性最强的一种形式, 具有较强的物理淬火能力、生物效力以及与反应的活性[56, 63]。植物种子内VE的含量及抗氧化能力与其基因型有关[64], 许多植物种子内γ -生育酚含量较α -生育酚高得多, 例如拟南芥[46]、樟子松[55]及大豆[59]等, 从而导致测定的种子内VE含量与种子活力的变化呈现多样性。也可能与贮藏时间及方式有关, 如, 在刚开始贮藏的3年内, 海滨碱蓬(Suaeda maritime)种子仍然保持较高的活力, 而且VE的含量也比较稳定, 其后, 种子活力和VE含量迅速降低, 且电解质渗出率增加[44]。人工老化与自然老化机理上的差异也是一个原因, 老化过程中VE的相关酶活性被损害, 限制了其生物合成, 而人工加速老化处理条件下该表现相对缓慢[3, 61, 62]。Giurizatto等[61]研究自然老化及人工老化的大豆种子发现, 种子内天然VE含量随贮藏期的延长而呈线性增加, 而且贮藏时间达到120 d后, 人工老化和自然老化之间大豆种子中VE含量才差异显著。此外, 外源VE还存在浓度及处理时间是否合适的问题, 即VE在种子老化中可能存在双重效应, 低浓度处理会延缓或修复种子的老化, 相反, 高浓度则会加剧。
目前, 关于VE对种子老化的影响仅限于两个方面:一方面为老化过程中内源VE含量的变化与种子活力的关系, 另一方面为外源VE处理对老化种子活力的影响。由于VE对种子老化的影响尚不清楚, 因此, 将会有越来越多的学者开展关于外源VE对种子老化影响的研究工作, 以确定VE对老化种子的影响机理。
Se及SA等活性物质也具有一定的清除ROS的作用, 有利于植物种子生物功能的完成, 保护植物种子免受生物或非生物胁迫的伤害。通过研究矮柱花草(Stylosanthes humilis)[65]、苦瓜(Momordica charantia)[66]、银槭[23]、黑麦草(Lolium perenne)[67]及黄瓜(Cucumis sativus)[68, 69, 70]等植物种子发现, 适当浓度的Se处理能够有效打破种子休眠, 降低幼苗中MDA含量及电导率, 提高种子贮藏后的发芽势、发芽率及萌动种子呼吸速率和淀粉酶活性, 并提高种子萌发后的幼苗质量、根系活力、幼苗中SOD、POD及CAT活性等生理指标, 促进幼苗的生长发育。同时, 还发现Se具有双重效应, 高浓度处理时, 老化种子的萌发及幼苗生长受到抑制, 相关的生理指标下降。通过对大葱(Allium fistulosum)[71]、花生(Arachis hypogaea)[22]及西瓜(Citrullus lanatus)[72]等植物种子的老化研究发现, 不同浓度的SA处理时, 种子的发芽率、发芽势、发芽指数及活力指数呈现先升高后降低的趋势, 而种子浸出液的电导率、可溶性糖含量及MDA含量均呈现先降低后增加的趋势。这表明SA对种子老化的影响具有双重效应, 低浓度SA浸种对种子膜系统具有修复作用, 延缓了种子的老化, 明显提高了种子质量, 促进其萌发的效果显著, 而高浓度SA处理则加剧了种子的老化进程[73]。而且, 由于植物种类、处理方式及时间的差异, SA延缓大葱、西瓜及花生种子老化的最佳浓度不同, 分别为0.05、0.10及15 。研究还发现, 由于理化指标测定时间至种子发芽(胚根突破种皮)期间相隔一段时间, 导致发芽效果最好的处理并非生理指标最好的处理, 因此, 在胚根突破种皮前测定理化指标更能代表不同处理对膜系统的修复效果[74]。总甾醇类(total sterols)在植物膜稳定性方面具有重要意义[75], 但研究贮藏过程中山毛榉种子的老化发现, 其与种子活力不相关[7]。茉莉酸甲酯(methyl jasmonate, MeJA)能促进休眠及逆境条件下花生和水稻种子的萌发[76, 77], 但JA是否能够促进老化种子的萌发, 还有待于进一步研究。
在植物中, ROS清除剂之间可以相互增效, 多种ROS清除剂联合使用, 其清除ROS的能力高于各组分在添加浓度下的效果之和, 这种相互作用叫做协同作用, 且其协同作用受ROS清除剂的浓度、反应体系等影响[78]。因此, 研究种子老化过程中ROS清除剂之间的协同增效作用, 寻找高效、低毒的复合型ROS清除剂, 对于高效利用ROS清除剂具有重要意义。目前, 协同作用已成为ROS清除剂研究领域中的热点之一。8 mg· L-1 AsA与0.4或0.8 mg· L-1 Se配合浸泡黄瓜种子, 能明显提高幼苗子叶和根系中SOD、POD及CAT的活性, 其效果明显优于单纯AsA或Se处理[69]。但0.5% AsA与0.3% VE和0.05% GSH共同处理人工加速老化的向日葵种子, 导致最佳温度条件下发芽率不同程度地降低, 且在AsA、VE或GSH单独处理时, 苗的异常率均没有变化, 而组合处理时, 苗的异常率却增加, 芽长和根长却均稍微增加[39], 这说明AsA、VE与GSH三者共同处理对人工加速老化的向日葵种子没有协同效应, 其原因尚不清楚。老化种子中AsA-GSH系统清除ROS的研究已经深入到细胞器水平, 主要以APX和MDHAR催化的AsA的氧化还原起作用, 而以GR和DHAR催化的GSH的氧化还原作用相对较弱[35]。采用浓度均为1 mmol· L-1的AsA和GSH共同处理0.5 h的燕麦老化种子发现, AsA和GSH的修复效果没有叠加作用[40]。抗氧化剂在线粒体水平上修复机理尚不清楚, 有待进一步研究探讨[79]。因此, 关于ROS清除剂之间的协同性对种子老化的作用效果还有待于进一步深入探索, 以期充分发挥ROS清除剂的作用效果, 为农业生产提供可靠的理论指导和技术支持。
种子老化是影响其贮藏及幼苗建成的关键问题。目前, 研究发现AsA、GSH、VE、Se及SA等ROS非酶促清除剂与种子活力关系密切, 能够延缓或修复部分种子的老化进程。虽然大部分种子具有相同的发育过程和生理特征, 但它们在大小、结构、储存物、生态学等类型及性质方面的差异较大, 导致ROS非酶促清除剂影响老化种子活力的潜在作用机理尚不清楚, 甚至不同ROS非酶促清除剂的作用效果尚存在争议, 所以, 这仍是未来种质资源迁地保存研究的热点问题之一。在研究ROS非酶促清除剂对老化种子的影响方面, 仅从目前单一的细胞生理方面考虑是不充分的, 必须整合已知的相关研究成果, 深入到细胞器水平上, 尤其是种子ROS产生的重要细胞器— — 线粒体, 利用双向荧光差异凝胶电泳技术深入探索非酶促清除剂清除ROS的酶学机理, 并结合功能基因组学的技术及手段探讨APX、SOD、CAT、GPX及GR等相关酶基因表达调控的分子机制。另外, 从种子超微结构的变化及其萌发后的生长性能等角度, 综合评价其清除ROS的能力、最适作用pH值、处理时效及其协同作用。在实际生产中, 仅靠添加外源ROS非酶促清除剂来延缓种子的老化是不够的, 还应通过生物学手段, 诱导增加内源ROS清除剂的种类和含量, 这将是防止种子劣变, 减轻老化的重要途径, 也是延长种子贮藏时间最理想的方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|


