第一作者:闵丹丹(1991-),女,陕西洛南人,在读硕士生,主要从事牧草种子研究。E-mail: [email protected]
以紫花苜蓿( Medicago sativa)种子为材料,以水、PEG-6000溶液(-0.6 MPa)、KNO3溶液(2%)、GA3溶液(100 μmol·L-1) 和CaCl2溶液(2%)为引发剂,研究各引发处理后的种子在不同温度、盐分和水分胁迫下的萌发和幼苗生长特性。结果表明,1)除引发显著提高低水势下以及KNO3引发显著促进高盐下的萌发率外( P<0.05),引发对紫花苜蓿在所有温度、盐分和水势下的萌发率均没有显著影响( P>0.05)。2)除CaCl2引发在10和15 ℃及PEG引发在高盐胁迫下的平均萌发时间没有影响外( P>0.05),引发均显著缩短了紫花苜蓿的平均萌发时间( P<0.05)。3)引发对紫花苜蓿在不同温度、盐分和水势胁迫下的根和苗生长的影响不同:水引发显著促进紫花苜蓿在10 ℃下根的生长, 但在其它条件下对根的生长无显著作用。水引发显著促进了紫花苜蓿在10 ℃和高盐胁迫下苗的生长。但除水引发外,所有引发处理均显著促进了紫花苜蓿在低水势下苗的生长,其中以KNO3引发效果最好( P<0.05)。
Germination and seedling growth of Medicago sativa seeds primed with H2O, PEG-6000(-0.6 MPa), KNO3 (2%), GA3 (100 mol·L-1) and CaCl2 (2%) were determined under different temperature, salt and water stress. The results showed that: 1) All priming treatments significantly increased germination percentage at low water potential but not under the other conditions except for a significant increase at severe salt stress condition by KNO3 priming. 2) Priming significantly decreased the average germination time except for at 10 and 15 ℃ after CaCl2 priming, or at high salt stress after PEG priming. 3) Effects of priming on seedling radicle and shoot growth varied with priming treatments, varieties and test conditions. For example, hydropriming significantly increased radicle growth at 10 ℃, but showed no effect under the other conditions. Hydropriming significantly increased shoot growth at 10 ℃ or under severe salt stress condition. In addition to hydropriming, all priming treatment significantly promoted alfalfa shoot growth under low water potential, among which KNO3 priming exhibited the optimal effect.
紫花苜蓿(Medicago sativa)是多年生优质豆科牧草[1], 具有营养价值高、适口性好、适应性强、耐贫瘠等特点, 因而广泛用于栽培草地的建设[2]。近年来, 随着国家退耕还林还草, 振兴奶业苜蓿发展计划等一系列政策的推行, 紫花苜蓿栽培草地的建设达到空前的高潮[3, 4]。但另一方面, 作为非粮作物, 我国紫花苜蓿主栽区位于自然条件相对严酷的干旱半干旱区域, 如黄土高原、黄淮海地区等。由于特殊的气候条件以及不合理的土地利用措施, 干旱化、土壤盐碱化、沙化已成为上述区域面临的主要环境问题[5, 6, 7, 8], 这往往导致紫花苜蓿出苗率低、建植难, 因而在一定程度上限制了其在上述区域的栽培利用。
采用抗逆性强的苜蓿品种或种子播前处理技术是解决这一问题的主要途径。种子引发(seed priming)作为一种播前处理技术, 可以增强种子活力, 改善种子发芽特性, 提高种子在田间的出苗率与出苗速率, 从而有利于紫花苜蓿的建植[9, 10, 11, 12, 13, 14]。紫花苜蓿种子引发的研究表明, 水引发可以显著提高种子的发芽指数、促进幼苗生长, 但对最终萌发率没有显著影响[15, 16]; PEG引发可以提高种子早期萌发率和发芽指数[7]; 引发处理能显著提高种子的发芽指数, 促进盐逆境下种子萌发和幼苗生长[6]; KNO3和CaCl2引发能明显提高种子活力及幼苗的抗逆性[17]; 沙引发能促进盐胁迫下种子的萌发和幼苗生长[18]。上述研究为筛选合适的引发方法, 提高紫花苜蓿在不同生境下的建植提供了有益的参考。但值得注意的是, 上述研究或者仅仅探讨了引发后未回干种子的表现[7, 15], 或者只是就种子在某种引发处理后在特定条件下的表现进行了评价[6, 12, 13]。考虑到种子在引发后可能的贮藏以及运输, 对引发后回干种子的评价是必要的。此外, 引发效果不仅受引发处理的影响, 同样受引发品种以及种子播种后环境条件的影响[13, 14, 19]。因而, 在多种条件下开展不同引发处理效果的比较研究对于筛选合适的引发方法, 从而有针对性地应用适宜的引发技术具有重要参考价值。基于此, 本研究主要探究各种引发方法对紫花苜蓿种子回干后在低温、水势和盐胁迫下的萌发和幼苗生长特性的影响, 旨在探索不同环境条件下适宜的种子引发技术。
陇东苜蓿和甘农3号种子来源于甘肃农业大学草业学院, 试验前置于4 ℃冷库贮藏。陇东苜蓿的千粒重是2.023 g, 硬实率为25.8%; 甘农3号的千粒重是1.972 g, 硬实率为3%。
1.2.1 引发方法 将5 g种子置入250 mL带盖塑料瓶中(盖上具小孔), 分别加入4.5 mL(种子重量的90%)蒸馏水(H2O)、-0.6 MPa 聚乙二醇(PEG-6000)、2%硝酸钾(KNO3)、2%氯化钙(CaCl2)和100 μ mol· L-1赤霉素(GA3), 充分混匀后, 置于(10± 1)℃恒温培养箱中引发36 h。引发期间, 每2 h将塑料瓶取出, 轻轻摇晃, 以确保种子均匀吸水。每引发处理3个重复。引发36 h后, 将引发种子倒出, 平铺置滤纸上, 室内(18~23 ℃, 相对湿度30%~45%)回干48 h。PEG引发后, 倒去PEG溶液, 用自来水轻轻冲洗5次后用吸水纸吸干种子表面水分, 如上所述回干48 h。
引发与回干处理参照范燕等[16]的方法进行。引发剂PEG-6000、KNO3、CaCl2以及GA3的浓度分别参考王彦荣等[7]、 楼坚锋等[6]、 梁帅克等[17]和Galhaut等[20]的研究进行设置。
1.2.2 引发处理对种子萌发响应温度的影响 采用纸上萌发法, 随机数取引发与对照(CK)种子各50粒、3个重复, 置于有两张湿润滤纸的玻璃培养皿中(直径9 cm), 分别于10、15和20 ℃的恒温培养箱中, 12 h/12 h(光照/黑暗)进行萌发试验, 共持续14 d。 根据种子萌发速率, 每12 h或24 h统计萌发种子数, 以胚根突出种皮2 mm视为萌发。第7天测定根长、苗长, 每重复测定5粒种子, 计算其均值。第14天统计死种子数、硬实种子数和新鲜种子数。 根据公式(1)、(2)计算萌发率(%)与平均萌发时间(d)。
萌发率=萌发种子总数/(总种子数-硬实种子数)× 100% (1)
平均萌发时间=∑ (Ti× Ni)/S(2)
式中:Ti为天数, Ni为试验第i天萌发的种子数, S为萌发种子总数。
1.2.3 引发处理对种子萌发响应盐分胁迫的影响 采用纸上萌发法, 随机数取引发与对照种子各50粒, 3个重复, 摆放于有两张滤纸的玻璃培养皿中(直径9 cm), 分别加入100、200、300 mmol· L-1的NaCl溶液5 mL, 置于20 ℃恒温培养箱中, 12 h/12 h(光照/黑暗)进行萌发试验, 共持续14 d。为保证种子维持在相对恒定的溶液浓度条件下, 封口膜封口, 每3 d换一次溶液, 萌发1周后将不再更换溶液, 但应保证封口膜完整。萌发率及根长、苗长的测定同1.2.2。
1.2.4 引发处理对种子萌发响应水分胁迫的影响 采用纸上萌发法, 随机数取引发与对照种子各50粒, 3个重复, 摆放于有两张滤纸的玻璃培养皿中(直径9 cm), 分别加入-0.3、-0.6、-0.9 MPa的PEG溶液5 mL, 置于20 ℃恒温培养箱中, 12 h/12 h(光照/黑暗)进行萌发试验, 共持续14 d。为保证种子维持在相对恒定的溶液浓度条件下, 用封口膜封口, 每3 d换一次溶液, 萌发1周后将不再更换溶液, 但应保证封口膜完整。萌发率及根长、苗长的测定同1.2.2。
采用SPSS 19.0软件对紫花苜蓿种子萌发和幼苗生长数据进行统计分析, 用Excel 2007绘图。显著性检验采用单因素方差分析(One-way ANOVA), Duncan法进行处理间均值的多重比较。
2.1.1 对种子萌发的影响 除GA3引发显著降低甘农3号在20 ℃的萌发率外(P< 0.05), 引发对紫花苜蓿在所有温度下的萌发率均没有显著影响(P> 0.05)(图1)。与此相反, 水、PEG以及GA3引发均显著降低了紫花苜蓿在各温度条件下的平均萌发时间(P< 0.05), 如20 ℃时, 相比CK, 水、PEG以及GA3引发后陇东苜蓿的平均萌发时间分别降低了12.9%、7.7%和8.8%(图2), 而甘农3号则分别降低了14.2%、6.3%和9.1%(图2); 但CaCl2引发对陇东苜蓿种子在 10、15 ℃下的平均萌发时间没有显著影响(P> 0.05)(图2)。
 | 图1 引发处理对陇东苜蓿和甘农3号在10、15和20 ℃下萌发率的影响 注:不同小写字母表示同一温度下不同引发处理间差异显著(P< 0.05), 相同字母表示引发处理间差异不显著(P> 0.05)。图2、图3和图4同。Fig.1 Effects of priming on germination of Longdong and Gannong No.3 at 10, 15 and 20 ℃ Note:Different lower case letters for the same temperature indicate significant difference among different priming treatments at 0.05 level same lower case letters for the same NaCl treatment indicate no significant difference among different priming treatments at 0.05 level. The same in Fig.2, Fig.3, and Fig.4. |
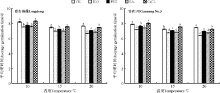 | 图2 引发处理对陇东苜蓿和甘农3号在10、15和20 ℃下平均萌发时间的影响Fig.2 Effects of priming on average germination time of Longdong and Gannong No.3 at 10, 15 and 20 ℃ |
2.1.2 对幼苗生长的影响 水引发显著促进陇东苜蓿在10与15 ℃下、甘农3号在10 ℃下根的生长(P< 0.05), 相比对照分别增长了63.9%、23.6%和42.9%, 但对紫花苜蓿在其它条件下根的生长没有显著影响。PEG引发除在20 ℃下显著促进陇东苜蓿根的生长外(P< 0.05), 对根的生长无显著作用(P> 0.05)(图3)。GA3与CaCl2引发对紫花苜蓿在各温度下根的生长均无显著影响(P> 0.05)。
 | 图3 引发处理对陇东苜蓿和甘农3号在10、15和20 ℃下根长的影响Fig.3 Effects of priming on root length of Longdong and Gannong No.3 at 10, 15 and 20 ℃ |
水引发显著促进了陇东苜蓿与甘农3号在10 ℃下苗的生长(P< 0.05), 较CK分别增加了59.9%和34%, 对15与20 ℃下苗的生长无显著作用(P> 0.05)(图 4)。GA3引发除显著促进陇东苜蓿在10 ℃下苗的生长外, 对苜蓿在其它条件下的生长无显著促进作用。PEG引发只对陇东苜蓿20 ℃下苗的生长有显著促进作用(P< 0.05)。CaCl2引发对紫花苜蓿幼苗的生长无显著促进作用(图4)。
2.2.1 对种子萌发的影响 引发对紫花苜蓿在盐胁迫下萌发的影响随盐分浓度、引发方法以及品种不同而异。随盐分浓度的增加, 种子萌发率均呈现下降的趋势(图5)。除KNO3引发在高盐胁迫下(300 mmol· L-1)比CK的萌发率显著提高了52.6%外(P< 0.05), 引发对陇东苜蓿在盐分胁迫条件下的萌发率没有显著影响(P> 0.05)。对于甘农3号, GA3引发显著降低了低盐(100 mmol· L-1 NaCl)胁迫下的萌发率, PEG、KNO3和GA3引发显著降低中度盐分(200 mmol· L-1 NaCl)胁迫下的萌发率, 较CK分别降低了20.8%、15.3%和15.1%, PEG引发显著降低了高盐(300 mmol· L-1 NaCl)胁迫下的萌发率(P< 0.05), 但在其它条件下没有显著影响(P> 0.05)(图5)。除PEG、GA3与CaCl2引发对陇东苜蓿在高盐胁迫下, 以及所有引发处理对甘农3号在高盐胁迫下的平均萌发时间没有显著影响外(P> 0.05), 引发都显著降低了紫花苜蓿在所有盐分胁迫下的平均萌发时间(P< 0.05)(图6)。
 | 图5 引发处理对陇东苜蓿和甘农3号在不同盐分浓度下萌发率的影响 注:不同小写字母表示同一NaCl浓度下不同引发处理间差异显著(P< 0.05), 相同字母表示引发处理间差异不显著(P> 0.05)。图6、图7和图8同。Fig.5 Effects of priming on germination percentage of Longdong and Gannong No.3 under salt stress Note:Different lower case letters for the same NaCl treatment indicate significant differences among different priming treatments at 0.05 level, and same lower case letters for the same NaCl treatment indicate no significant difference among different priming treatments at 0.05 level. The same in Fig.6, Fig.7, and Fig.8. |
 | 图6 引发处理对陇东苜蓿和甘农3号在不同盐分浓度下平均萌发时间的影响Fig.6 Effects of priming on average germination time of Longdong and Gannong No.3 under salt stress |
2.2.2 对幼苗生长的影响 除GA3引发对所有盐和PEG引发对高盐下陇东苜蓿的根长有显著抑制外(P< 0.05), 其它引发处理对陇东苜蓿的根长没有显著影响(P> 0.05)。水引发显著促进甘农3号在高盐胁迫下根的生长, 而GA3引发对所有盐处理、KNO3引发对高盐及PEG对中、高盐下的甘农3号的根长有显著抑制作用(P< 0.05)。其它引发处理对紫花苜蓿的根长没有显著影响(图7)。
 | 图7 引发处理对陇东苜蓿和甘农3号在不同盐分浓度下根长的影响Fig.7 Effects of priming on root length of Longdong and Gannong No.3 under salt stress |
PEG引发显著促进陇东苜蓿在低盐胁迫下苗的生长(P< 0.05), 较CK增加了21.4%, 水引发显著促进陇东和甘农3号苜蓿在高盐胁迫下苗的生长。而GA3引发对中盐、PEG引发对高盐下的陇东苜蓿苗长有显著抑制作用, GA3引发对中盐、PEG和CaCl2引发对中和高盐及KNO3对高盐下的甘农3号的苗长有显著抑制作用。其它引发处理对紫花苜蓿苗的生长无影响(图8)。
2.3.1 对种子萌发的影响 引发对紫花苜蓿在水分胁迫下萌发率的影响随品种、水势梯度、引发方法的不同而异。随胁迫的增强, 萌发率均呈现下降的趋势。除在-0.3 MPa时PEG引发显著降低甘农3号的萌发率外, 引发对紫花苜蓿在中、高水势下的萌发率均没有显著影响(P> 0.05)。在低水势(-0.9 MPa)下, 除水引发的陇东苜蓿萌发率与CK无显著差异外, 其余引发均显著提高了紫花苜蓿的萌发率(P< 0.05)(图9)。引发均显著降低了紫花苜蓿在所有水分胁迫下的平均萌发时间(P< 0.05)(图10)。
 | 图9 引发处理对陇东苜蓿和甘农3号在水分胁迫下萌发率的影响 注:不同小写字母表示同一水势下不同引发处理间差异显著(P< 0.05)。图10、图11和图12同。Fig.9 Effects of priming on germination of Longdong and Gannong No.3 under salt stress Note:Different lower case letters for the same water potential treatment indicate significant differences among different priming treatments at 0.05 level. The same in Fig.10, Fig.11, and Fig.12. |
 | 图10 引发处理对陇东苜蓿和甘农3号在水分胁迫下平均萌发时间的影响Fig.10 Effects of priming on average germination time of Longdong and Gannong No.3 under salt stress |
2.3.2 对幼苗生长的影响 水引发对紫花苜蓿在各水势条件下根的生长均无显著影响(P> 0.05)(图11)。PEG引发显著促进了紫花苜蓿在低水势和高水势下根的生长(P< 0.05), 但对其在中水势条件下的生长无显著影响。除对高水势条件下陇东苜蓿根的生长无显著作用外, KNO3引发显著促进了紫花苜蓿在各水势条件下根的生长。除对陇东苜蓿在高水势条件下、甘农3号在中水势条件下根的生长无显著促进作用外, GA3引发显著促进了紫花苜蓿不同水势条件下根的生长。除显著促进紫花苜蓿在低水势条件下根的生长外, CaCl2引发对紫花苜蓿在各水势条件下根的生长无显著影响(图11)。
 | 图11 引发处理对陇东苜蓿和甘农3号在水分胁迫下根长的影响Fig.11 Effects of priming on root length of Longdong and Gannong No.3 under salt stress |
KNO3引发显著增加了陇东苜蓿在中低水势胁迫下苗的生长(P< 0.05), 对陇东苜蓿在高水势下苗的生长没有显著影响(P> 0.05)。然而, 除水引发外, 所有引发处理均显著促进了陇东苜蓿在低水势下苗的生长(P< 0.05)(图12)。与此一致, 除水引发外, 其它引发处理均显著促进了甘农3号在低水势下苗的生长(P< 0.05); 但KNO3引发在中水势下、GA3引发在高水势下显著促进了苗的生长(P< 0.05), 较CK增幅分别为41.3%和42.1%。
紫花苜蓿种子的萌发率、萌发速率及其抗逆性是影响其栽培草地建植的主要因素。种子萌发和幼苗建成是植物生命周期的关键阶段, 也是对外界环境因子反应最敏感的时期之一[21], 其中干旱和土壤盐渍化是影响植物成功建植的重要因素。引发能促进种子萌发和幼苗生长、缩短种子的萌发时间、提高种子活力、增强幼苗的抗逆性和建植率[11, 22, 23, 24, 25]。引发对种子的萌发和幼苗生长特性的影响随引发方法、萌发温度、盐分和水势胁迫的不同而有差异[13, 19, 26, 27, 28]。Bradford[29]认为在低水势或其它逆境条件下测定引发种子的萌发率是评价种子引发效果的有效途径。本研究显示, 引发除显著提高了低水势下的萌发率外, 对紫花苜蓿的萌发率均没有显著影响(P> 0.05)。除CaCl2引发在10和15 ℃及PEG引发在高盐胁迫下的平均萌发时间没有影响外, 引发均显著降低了紫花苜蓿的平均萌发时间(P< 0.05)。这与王彦荣等[7]和刘慧霞和王彦荣[15]的研究结果一致, 即引发显著缩短了种子的萌发时间, 但对其最终萌发率无显著影响。这表明引发可以缩短种子的出苗时间, 并集中萌发, 这有利于种子在逆境条件下快速完成萌发的代谢过程, 从而规避不利因素对种子萌发的限制。
温度是控制种子萌发及生长的主要因子[30, 31, 32], 它能够影响种子的萌发能力与萌发速率[33], 适宜的温度能加速种子吸水, 还能促进种子内的物质代谢[34]。本研究显示, 水引发显著促进紫花苜蓿在低温(10 ℃)胁迫下的幼苗生长(P< 0.05)。这与紫花苜蓿[35]和花椰菜(Brassica oleracea)[36]种子引发后, 在低温下水引发效果较好的结果一致。这表明水引发可提高早春和晚秋播种种子的萌发率和幼苗的成活率, 从而获得高产。
种子的萌发是从吸水开始的, 而盐胁迫下种子的吸水受到抑制, 阻碍种子萌发[37]。引发随盐胁迫程度的增强, 紫花苜蓿种子的萌发率和幼苗生长均呈现下降的趋势, 这与在玉米(Zea mays)[38]上的研究结果一致。水引发显著促进了紫花苜蓿高盐胁迫下幼苗的生长。这与水引发能够增强植物对不良环境的抵抗能力[35]相一致。PEG引发显著降低紫花苜蓿在高盐胁迫下的幼苗生长。这与对玉米[27]研究结果一致。
种子在萌发和幼苗生长阶段对干旱胁迫非常敏感[39]。何淼等[40]发现在超过20% PEG胁迫下, 幼苗的膜系统受到严重伤害, 甚至造成失水死亡。本研究表明, 引发随水势梯度的降低, 紫花苜蓿种子的萌发率和幼苗生长均呈现下降的趋势, 这与秦文静和梁宗锁[41]关于豆科牧草萌发期对干旱胁迫的响应及抗旱性评价的研究结果一致。除水引发外, 所有引发处理均显著促进了紫花苜蓿在低水势下幼苗的生长, 其中以KNO3引发效果最好。这与王彦荣等[7]关于紫花苜蓿在低水势下引发效果更明显的结果一致, 这可能与引发提高种子活力, 从而增强了种子的萌发抗逆性有关。KNO3和GA3引发显著促进了紫花苜蓿在各水势条件下根的生长。CaCl2引发显著促进了紫花苜蓿在低水势条件下根的生长。KNO3引发显著促进了紫花苜蓿在中水势条件下(-0.6 MPa)苗的生长。这可能与无机盐离子对细胞的渗透调节作用有关。
水引发可以缩短陇东苜蓿种子在20 ℃条件下的T50, 比对照提前了1 d[15]。但本研究发现, 水引发后种子的T50仅比对照提前了0.34 d(数据未显示)。造成这种差异的原因可能是本研究使用的是引发后回干种子, 而前人研究使用的是未回干种子[15]。考虑到种子引发后可能的贮藏或运输问题, 因而使用引发后未回干种子进行引发效果的评估在一定程度上可能高估了引发的效果。
1)在低温胁迫下, 采用水引发可以加快幼苗的快速建植, 而规避早春低温对幼苗的伤害。
2)水引发显著促进高盐胁迫下的幼苗生长, 可作为盐碱地的苜蓿播前处理技术。
3)各引发处理可显著提高低水势下紫花苜蓿种子的萌发率与萌发速率, 且除水引发外, 所有引发处理均显著促进了紫花苜蓿在低水势下幼苗的生长, 其中以KNO3引发效果最好。因而, KNO3引发可作为干旱条件下苜蓿播种的播前处理方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|





