第一作者:朱习雯(1993-),女,湖北郧县人,在读硕士生,研究方向为草业生产。E-mail:[email protected]
以采自新疆天山北坡的醉马草( Achnatherum inebrians)株体为供体植物,红豆草( Onobrychis viciaefolia)、紫花苜蓿( Medicago sativa)、无芒雀麦( Bromus inermis)3种补播牧草及醉马草自身为受体植物,采用培养皿滤纸法研究返青期醉马草不同营养器官水浸液在0.2、0.1、0.05和0.025 g·mL-1 4个浓度下对这4种植物种子萌发的化感作用。结果表明,醉马草株体水浸液对4种植物种子的化感作用均表现为抑制作用,且敏感性从强到弱依次为醉马草>无芒雀麦>红豆草>紫花苜蓿;不同部位的醉马草水浸液化感作用强度为茎叶>根;醉马草株体水浸液对紫花苜蓿种子的萌发具有低浓度(0.025 g·mL-1)促进、高浓度(0.2 g·mL-1)抑制的作用,而对无芒雀麦、红豆草和醉马草种子,则不同浓度呈现出不同程度的抑制效应。因此,建议使用紫花苜蓿等耐受性较好的牧草来对醉马草爆发区进行春季补播恢复。
This study determined the allelopathy effects of Achnatherum inebrians growing in Tianshan Mountains at the returning green stage on seed germination of Onobrychis viciaefolia, Medicago sativa, Bromus inermis and A. inebrians by treating seeds with the aqueous extract of different parts of A. inebrians with four concentrations (0.2,0.1,0.05,0.025 g·mL-1). The results showed that the aqueous extract of A. inebrians had inhibitory effects on germination of four species, and the allelopathic sensitivity of four species ranked as: A. inebrians > B. inermis> O. viciaefolia> M. Sativa. Leaf showed a stronger allelopathy effect than root. Germination of M. sativa increased and then decreased as aqueous extract concentration increasing, whereas germination of B. inermis, O. viciaefolia and A. inebrians decreased to some extent at all testing concentration. Thus, M. sativa is recommended to use for restoring degraded grassland infested by A. inebrians.
醉马草(Achnatherum inebrians)是一种重要的烈性毒草, 广泛分布于我国青海、内蒙古、新疆和甘肃等地[1]。由于其具有抗寒、耐旱等优势, 因此在退化草地中蔓延日益严重。有资料显示, 新疆天山南北坡的醉马草不同程度退化草地面积有近40万hm2; 轻度退化草地醉马草盖度占10%~20%, 中度退化草地醉马草盖度占30%~40%, 严重退化草地的醉马草盖度竟超过90%, 几乎丧失了利用价值[2]。目前, 学者们对醉马草的生态学特性[3]、有毒成分[4, 5, 6]、危害防治[7, 8]和内生真菌[9, 10]等方面进行了大量研究, 而对其有效防控是生产及生态上亟待解决的问题。在土壤、降水及地形条件良好的醉马草发生区进行草地补播成为对其进行防控的常用方法, 防控可否成功的关键就在于如何提高优良牧草在醉马草群落中的定居能力和竞争能力。其中, 醉马草在补播种种子萌发这一过程中具有重要作用。
化感作用是指植物本身产生的某种物质, 通过不同方式释放到周围环境中, 从而对另一种植物产生不同程度的互相排斥或促进作用[11]。而植物的自毒作用就是化感作用的一种特殊类型[12], 是植物种内相互影响的方式之一[13]。已有研究表明[14, 15], 毒害草的化感作用可能是形成草地退化的成因之一。目前, 大多学者的研究主要集中于醉马草对无芒雀麦(Bromus inermis)种子萌发的影响[16]及其根围土壤对牧草种子的萌发[17], 而在醉马草对其它补播牧草的化感作用方面研究较少。
因此, 本研究选择无芒雀麦、紫花苜蓿(Medicago sativa)和红豆草(Onobrychis viciaefolia)3种常用的补播牧草作为受体植物, 从化感作用的角度出发, 研究返青期醉马草根和茎叶水浸液对3种补播牧草及自身种子萌发的影响, 以期为醉马草的入侵机理和防控提供科学的理论依据。
采样区为新疆阿克苏乡春秋草地, 地理位置为43.704 10° -43.705 17° N, 87.687 63° -87.688 42° E, 海拔1 159~1 189 m。由于长年过度放牧, 目前醉马草大量发生, 逐渐成为优势种, 在新疆具有一定的代表性。
1.2.1 供体植物 2014年4月于醉马草返青期, 在研究区内选择相同海拔、相同坡度的区域, 设置10 m× 10 m的5个典型样地, 从各样地中选取株高21 cm、丛径宽7 cm左右的植株5株, 共计25株。
1.2.2 受体植物 选择醉马草发生区常用的3种补播牧草种子[18]及醉马草自身种子, 即无芒雀麦、红豆草、紫花苜蓿、醉马草。其中, 无芒雀麦、红豆草和紫花苜蓿种子由新疆克劳沃草业有限责任公司提供, 醉马草种子采自试验区。
1.3.1 水浸液制备 将采集的醉马草植株洗净晾干, 分地下 (根)与地上(茎叶)两个部分, 剪为< 2 cm长的小段, 放入500 mL锥心瓶内, 将其配成0.2、0.1、0.05和0.025 g· mL-1 4个质量浓度的溶液[9], 室温(20~24 ℃)下浸泡48 h(每隔12 h震荡5 min), 经双层纱布过滤后, 即得醉马草根部和茎叶部水浸液, 4 ℃保存备用。
1.3.2 种子萌发试验 2014年6月, 采用培养皿滤纸法[19]探讨不同浓度及部位醉马草水浸液对4种受体植物的化感作用。试验在铺有两层滤纸、直径为12 cm的培养皿中进行, 每个培养皿均匀放入50粒饱满的受体植物种子, 各处理分别加入0.2、0.1、0.05和0.025 g· mL-1的水浸液6 mL, CK组加入等量蒸馏水, 每个处理设置3个重复。培养皿放入人工气候箱, 每天25 ℃持续8 h, 15 ℃持续16 h。光照时间为25 ℃/8 h, 光强度750~1 250 lx(冷白荧光灯)[9]。每隔24 h记录1次受体种子萌发的数量(以胚根长突破种皮为准[20]), 后参照国家标准[19]结束试验, 并测量胚根和胚芽的长度和重量。
计算发芽势(GE)、萌发率(GR)、萌发指数(GI)、化感作用效应指数(RI)、植物平均敏感指数(MR)[21]。参照Willamson和Richardson[22]的方法计算化感作用效应指数(RI)。
GR=萌发终期(规定日期内)全部萌发种子数/供试种子数× 100% (1)
GE=n/N× 100%. (2)
式中:n为第5天萌发种子数, N为供试种子数。
GI=∑ (Gt/Dt). (3)
式中:Gt为第7天内发芽数, Dt为发芽天数。
RI=1-C/T (T≥ C) (4)
RI=T/C-1 (T< C)(5)
式中:RI> 0时表现为促进作用, 反之则为抑制作用。T为各指标处理数值, C为各指标对照数值。
MR=
式中:MR代表平均敏感指数; a为数据项RI; n为该级别数据(RI)的总个数。当MR> 0时为促进作用, 反之则为抑制作用。
试验数据均在Excel 2003中录入, 运用SPSS13.0软件, 采取单因素方差分析(One-way ANOVA)和最小显著性差异法(LSD)进行方差分析和显著性检验。其中, 萌发率和发芽势的数据均采用反正弦转换后进行数据统计分析。
随着根水浸液浓度的升高, 4种植物种子萌发的各项指标值大体呈波动下降趋势(表1)。对3种补播牧草来说, 仅0.2 g· mL-1处理下红豆草的胚根长较CK表现出显著增加趋势(P< 0.05), 其余各指标均无显著差异(P> 0.05)。对醉马草自身而言, 0.2 g· mL-1处理下的萌发率显著低于0.025、0.05 g· mL-1和CK(P< 0.05)处理下的, 0.2 g· mL-1处理下的萌发指数显著低于0.025 g· mL-1和CK的(P< 0.05), 0.025、0.1和0.2 g· mL-1处理下的胚根长显著低于CK的(P< 0.05), 0.05 g· mL-1处理下的芽长显著高于0.2 g· mL-1的 (P< 0.05), 0.025 g· mL-1处理下的芽重显著高于CK的, 而发芽势和胚根重则无显著变化(P> 0.05)。
| 表1 醉马草根水浸液对4种植物种子萌发特性的影响 Table 1 Effect of extracting aqueous of root from A. inebrians on seed germination characteristics of four species |
不同浓度的醉马草茎叶水浸液对4种植物种子萌发的各项指标有一定的影响, 随着茎叶水浸液浓度的增加, 各项指标值大体上呈下降趋势(表2)。对补播牧草而言, 醉马草茎叶水浸液仅对无芒雀麦的胚根重、红豆草的胚根长、芽长和芽重无显著影响(P> 0.05)。红豆草和紫花苜蓿各浸提液处理下的胚根重均显著低于CK的(P< 0.05), 其余各指标表现为0.2 g· mL-1处理下的显著低于0.025 g· mL-1和CK下的(P< 0.05); 对醉马草自身来说, 除胚根重和芽重外, 其余各指标均呈现出0.05~0.2 g· mL-1处理下的显著低于CK的(P< 0.05), 表现为不同程度的抑制作用。
| 表2 醉马草茎叶水浸液对4种植物种子萌发特性的影响 Table 2 Effect of extracting aqueous of shoot and leaf from A. inebrians on seed germination characteristics of four species |
通过计算化感作用敏感指数(RI)得出, 无芒雀麦、紫花苜蓿、红豆草和醉马草种子的萌发率、发芽势和萌发指数3个指标的RI值均为负值, 且萌发指数的化感作用远远强于萌发率, 说明醉马草株体水浸液对其种子萌发产生了不同程度的抑制效应。从RI值的正负和绝对值的大小来看, 4种植物种子敏感性由强到弱依次为醉马草> 无芒雀麦> 红豆草> 紫花苜蓿(图1)。
 | 图1 醉马草株体水浸液对4种植物种子化感作用的化感作用效应指数Fig.1 Allelopathy effect index of four plant species affected by A. inebrians aqueous extract |
进一步用植物平均敏感指数(MR)分析醉马草根、茎叶不同部位水浸液对4种植物种子的化感作用发现, 均呈现出一定程度的抑制作用, 并且其作用强度都表现为茎叶水浸液的化感作用远远大于其根水浸液的化感作用(图2)。
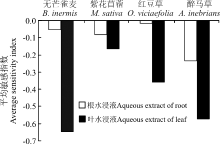 | 图2 醉马草不同部位水浸液对4种植物种子的平均敏感指数Fig.2 The average sensitivity index of aqueous extract of different parts from A. inebrians to four plant species |
醉马草株体水浸液处理4种植物种子后, 化感作用表现为低浓度促进、高浓度抑制的作用(图3)。对无芒雀麦、红豆草和醉马草种子表现出一定程度的抑制效应, 而对紫花苜蓿种子来说, 在0.025 g· mL-1浓度下表现为促进作用, 在大于0.025 g· mL-1浓度下呈现出不同程度的抑制作用。且4种植物种子均表现为随着浓度的不断升高, 抑制效应也逐渐增强。
化感作用表现为促进和抑制作用两个方面, 在杂草入侵过程中, 是指一个活体植物通过向环境释放自身产生的某种化学物质, 从而影响周围植物生长发育的过程[23]。资料显示, 醉马草株体水浸液对4种植物种子萌发表现出不同程度的抑制作用, 浓度越大, 受抑制作用越显著。而且可以看出, 醉马草对植物种子萌发指数的影响远大于对萌发率的影响, 导致植物种子发芽时间延后。以上结果表明, 醉马草的化感作用将严重影响牧草对地上和地下资源的竞争能力。
本研究显示, 醉马草不同部位水浸液对受体植物的种子萌发显示一定的化感活性, 其中茎叶水浸液对受体植物的化感作用远强于根水浸液, 说明茎叶是集中表现醉马草化感作用的特定部位。在相同浓度下, 结实期醉马草的根、茎、叶水浸液对无芒雀麦种子萌发化感抑制作用由强到弱依次表现为叶> 茎> 根[16]。此外, 已有研究结果[24]显示, 植物不同部位的化感作用具有一定的差异性, 一般会比较集中表现于某一个特定器官, 如黄帚橐吾(Ligularia virgaurea)集中于根部[25]、沙打旺(Astragalus adsurgens)集中于叶[26]、银胶菊(Parthenium hysterophorus)集中于叶和果实[24]等。可见, 各营养器官水浸液的化感作用在不同受体间具有一定的差异性, 这可能与器官中存在化感物质及其含量有关, 还有待于进一步研究。
化感作用的重要研究内容是化感物质的浓度效应。资料显示, 化感作用对受体植物的影响因浓度的不同会存在一定差异, 体现出其具有明显的浓度效应[27]。本研究表明, 醉马草株体水浸液对无芒雀麦、红豆草和醉马草种子表现出一定程度的抑制作用, 且浓度越大化感效应越显著, 而对紫花苜蓿种子来说, 在0.025 g· mL-1浓度下表现为促进作用, 在大于0.025 g· mL-1浓度下呈现出不同程度的抑制作用。
醉马草株体水浸液对其种子萌发和胚生长具有一定的自毒作用, 且作用强度随水浸液浓度的增大而增强, 具有浓度梯度效应, 远远高于对其余3种补播牧草的影响。对于不同器官的醉马草水浸液来说, 同样也表现为茎叶> 根。
醉马草株体水浸液对4种植物种子化感作用的敏感性由强到弱表现为醉马草> 无芒雀麦> 红豆草> 紫花苜蓿, 且抑制效应均表现为茎叶> 根。醉马草株体水浸液处理无芒雀麦、红豆草和醉马草种子后, 均表现出抑制作用; 紫花苜蓿种子则表现出低促高抑现象。因此, 建议使用紫花苜蓿等耐受性较好的牧草来对醉马草爆发区进行春季补播恢复。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|



