第一作者:程航(1992-),女,河南新县人,在读博士生,研究方向为牧草育种与良种繁育。E-mail:[email protected]
种子作为最基本的生产资料,是农业生产得以发展的必要条件。老化将导致种子质量下降,最终失去生命力,给生产带来巨大经济损失。因此,研究种子老化机制对寻找应对种子老化的办法具有重要的意义。目前,关于种子老化的研究大多集中在生理生化变化方面,而随着分子生物学技术的飞速发展,合理运用这些技术,必将使从更深层次解释种子老化机制成为可能。本文对近年来种子老化分子生物学方面研究取得的成果进行了综述,发现种子老化后其遗传完整性降低,与能量代谢、信号转导、刺激响应、衰老死亡以及糖酵解途径等相关的基因表达发生变化,一些与脂质过氧化及DNA损伤修复相关的基因功能已得到验证。最后对种子老化机理的研究前景做出展望,指出蛋白和mRNA定位、基因功能研究以及完善信号转导途径的重要性。
It is necessary to develop the agricultural production of seeds which are considered as basic materials. However, seed aging leads to a decline in seed quality and ultimately to the loss of seed vitality, which causes huge economic losses in agricultural production. Thus, it is very important to conduct research on the aging mechanism, in order to identify suitable methods to control seed aging. Currently, most studies on seed aging focus on physiological and biochemical changes. It is possible to accurately determine the aging mechanism by using the techniques of molecular biotechnology, which are rapidly developing. This paper summarizes the achievements of molecular biology studies on seed aging. The genetic integrity of seeds was found to be lower after aging. Genes related to energy metabolism, signal transduction, stimulus-response, and the glycolytic pathway, among others, were differentially expressed after seed aging. Some genes that participate in lipid peroxidation and repair of DNA damage were identified. Developing trends in the study of the seed aging mechanism are also discussed. Localization of proteins and mRNAs, gene function analysis, and characterization of the signal transduction pathways will be important areas of focus in the future.
在农业生产中, 种子是最基本的生产资料, 其涵义非常广泛, 凡可以直接用作播种材料的植物器官都称之为种子[1]。种子生理成熟时, 活力达到最高, 进入储藏或休眠阶段后, 活力开始下降, 不可避免地发生老化, 进而种子质量降低, 影响生产。一直以来, 很多学者致力于研究种子老化的机理, 以期找到应对储藏过程中种子老化的办法。由McDonald[2]总结提出的脂质过氧化是目前接受度最高的一种解释种子老化的模型, 该模型指出, 种子内部发生的自动氧化或者是在氧化酶的作用下产生的自由基, 会攻击脂类物质, 造成脂类物质过氧化, 促使种子老化。以往关于种子老化的研究多集中在老化过程中种子生理生化的变化[3]和引发对种子老化的影响[4]等方面, 从分子生物学的角度解释种子老化机理的报道并不多见, 但结合分子生物学技术研究种子老化机理是必然趋势。为此, 就近年来种子老化相关的分子标记、组学研究和基因功能验证等研究情况进行阐述, 并对种子老化的研究趋势和热点提出个人见解, 以期为种子老化机理的研究提供理论依据。
分子标记是以生物个体间遗传物质内核苷酸序列差异为基础的, 是DNA水平遗传变异的直接反应。目前已建立了多种分子标记, 如以聚合酶链式反应(polymerase Chain Reaction, PCR)为基础的简单重复序列技术(simple sequence rRepeat, SSR)、简单重复序列区间DNA标记技术(inter-simple sequence repeats, ISSR)、随机扩增多态性DNA标记技术(random amplified polymorphic DNA, RAPD)、甲基化敏感扩增多态性技术(methylation sensitive amplified polymorphism, MSAP)(表1), 以及以分子杂交为基础的限制性内切酶片段长度多态性(restriction fragment length polymorphism, RFLP)和以DNA序列为基础的序列特异性扩增区技术(sequence-characterized amplified regions, SCAR)。由于直接以DNA形式表现, 不受时间空间的限制, 所以不存在表达与否的问题, 而且数量极多, 遍及整个基因组, 检测手段简单快速[5], 因此得到了广泛的应用。遗传完整性指种质原始的遗传组成状态得到完全的保存[6], 而在种子储藏的过程中, 老化不可避免, 进而导致DNA水平的变化, 遗传完整性会有不同程度的丧失, 因此分子标记技术在种子老化方面的应用主要集中在老化对遗传完整性的影响方面。
| 表1 主要分子标记技术的优缺点 Table 1 Merits and defects of the main molecular marker technologies |
简单重复序列又称微卫星, 它是一段1~6 bp的DNA[7, 8]。该技术的优点是重复性好, 在基因组中随机分布, 标记数量多, 所需DNA 量少[9]。SSR分子标记多用于分析种子老化对遗传完整性的影响。使用SSR分析老化处理后的玉米(Zea mays)种子, 与未老化组相比, 其多态性条带百分率、等位基因数、有效等位基因数、基因多样性指数、Shannon指数等遗传参数均有所下降[10], 表明老化降低了玉米种子遗传完整性。这与在大豆(Glycine max)[11]和扁蓿豆(Melissitus ruthenica)[12]种子中的研究结果一致。另外, SSR技术在一些物种的遗传图谱构建和老化相关QTL分析上也有应用, 如玉米[13]和大豆[14]。但是SSR分子标记技术也存在一些缺点, 如种属特异性强, 需要测序, 所需费用较多[15]。
ISSR最早是由Zietkeiwitcz 等[16]在SSR的基础上建立起来的, ISSR引物设计较SSR简单, 不需要预先知道基因序列, 所需DNA量较少、成本低、技术要求低、操作简单[17]。这些优点使其广泛应用于多个物种的种子老化后遗传物质完整性的研究。利用ISSR分子标记检测不同老化程度扁蓿豆的种质遗传稳定性的研究[18], 与未老化组相比, 老化扁蓿豆种子的多态性位点百分率(PPB)、等位基因数(Na)、有效等位基因数(Ne)、基因多样性指数(H)、Shannon指数(I)等遗传参数均较低, 且随老化程度的加重, 各参数呈下降的趋势, 表明老化处理能够降低扁蓿豆的遗传稳定性; SSR分子标记也验证了以上结果, 但SSR标记检测的多态性位点低于ISSR标记, 说明ISSR分子标记更适用于扁蓿豆种质遗传完整性变化的分析研究[19]。采用ISSR分子标记对老芒麦(Elymus sibiricus)老化种子遗传完整性的研究[20], 也获得了类似的结果, 随着老化程度的加重, 老芒麦种子发芽率逐渐降低, 各遗传参数也下降, 基因组DNA片段消失或颜色变浅, 并出现特异的DNA片段, 这些变化多集中在750-2 000 bp和250-500 bp的范围。其它物种, 如芥菜(Brassica juncea)[21]、水稻(Oryza sativa)[22]和锦鸡儿(Caragana arborescens)[23], 其人工老化种子的ISSR标记分析也证实了老化使基因组DNA受损, 其中芥菜种子DNA片段损伤的区域为100-250和750-2 000 bp, 水稻种子为350-400和600-700 bp。但是, ISSR分子标记也具有一些缺点, 例如它在多数情况下不能区别一个位点扩增的DNA片段, 引物在筛选上具有相对的不随机性[24]。
RAPD技术具有很多优点, 如DNA用量很少、所用引物没有严格的种属界限、不需要使用同位素等[25, 26], 也是多用于种子老化的遗传完整性分析。对大豆种子进行老化处理后利用RAPD分析发现, 扩增产物中弱带增多, 而且对比老化的大豆种胚和子叶中DNA的RAPD扩增条带发现, 随着老化程度的加深, 遗传变异会增加[27]。黄瓜(Cucumis sativus)种子[28]和甘蓝(Brassica oleracea)种子老化后的RAPD扩增条带也出现了强带变弱或消失、弱带增多的现象, 并且使用PEG渗调后, DNA带与未老化对照基本相同[29, 30]。但是, 也有报道称大豆种子[31]和红麻(Hibiscus cannabinus)种子[32]进行老化处理后, RAPD分析发现其遗传完整性没有受到影响。
MSAP优点是不需要知道被测DNA的序列信息, 可快速检测出基因组DNA中的甲基化位点, 所以该技术被应用于老化种子基因组DNA甲基化变异的研究, 以期从表观遗传学的角度分析老化种子的活力。将玉米单交种郑单958和先玉335进行人工老化, MSAP分子标记发现, 玉米种子活力降低的主要原因是CG+CHG甲基化水平升高, 而且种子的活力指标、生理指标与CG甲基化程度相关性较高, 但不同的是, 郑单958的 CG甲基化程度与电导率、丙二醛含量呈负相关, 与过氧化物酶和过氧化氢酶活性呈正相关, 而先玉 335的CG甲基化与电导率、丙二醛呈正相关, 与过氧化物酶和过氧化氢酶活性呈负相关, 因此, 郑单958和先玉335种子老化的 DNA 甲基化调控机制不同[33]。使用MSAP分子标记研究花生(Arachis hypogaea)和水稻种子老化与DNA甲基化的关系发现, 随种子老化程度的加深, 种子活力不断下降, 不同组织的DNA甲基化状态和水平是不同的, 表明老化种子的DNA甲基化在时间和空间上具有差异性[34]。
在种子老化领域, 组学研究多集中在使用转录组学或蛋白质组学的手段寻找种子老化相关基因、蛋白或生物学过程。
以DNA为模板合成RNA的转录过程是基因表达的第一步, 同时受内源和外源因子的调控。转录组学是一门在整体水平上研究细胞中所有基因转录及转录调控规律的学科, 反映的是生物的特定器官、组织在特定的发育、生理状态下所有基因的表达水平, 因此, 可以用转录组来比较不同组织或不同生理条件下基因水平的表达差异, 从而研究生理功能相关的基因。然而, 转录组学也有一定的局限性, 转录丰度与基因表达的最终产物的含量或者活性之间没有必然的关联, 还存在转录后调控等过程。目前, 各种转录组学研究技术已应用到生命科学研究的很多领域, 种子老化的转录组学研究也有报道。对豌豆(Pisum sativum)种子进行人工老化, 使用基因芯片技术比较正常种子与不同老化时间(8, 12, 15 d)种子的转录水平基因表达差异, 结果表明, 在种子老化的过程中, 共有717个差异表达的基因, 其中330个上调, 387个下调, 并且在15 d时差异表达的基因相对较多, 这些基因多与蛋白翻译后加工、翻转, 核糖体结构等相关, 分析发现转录组重编程能够影响细胞程序性死亡的进程, 并降低抗氧化能力, 最终种子生活力下降[35]。将玉米种子人工劣变处理72 h, 利用数字基因表达谱技术共筛选出人工劣变玉米种胚差异表达的基因4 713个, 其中上调表达2 874个, 下调表达1 839个, 这些基因多涉及能量代谢、信号转导、刺激响应和衰老死亡等过程, 分析发现表达变化的基因主要是糖酵解途径受到抑制, 导致活性氧(reactive oxygen species, ROS)的产生和积累, 最终使种子丧失活力[36]。同时, 采用cDNA-AFLP分析玉米种子老化相关基因也获得了类似的结果[37]。低温储藏通常有利于正常种子寿命的延长, 但是对于顽拗型种子, 研究结果很不一致, 采用cDNA-AFLP对茶树(Camellia sinensis)种子在低温储藏过程差异表达基因研究中, 获得了132条差异基因片段, 对其中15条克隆测序, 获得8条差异片段, 有6条基因与已知功能基因相关, 分别是金属蛋白、老化蛋白、蛋白激酶、人类表皮生长因子、核酸和蛋白转录调控因子、水稻编码假设蛋白[38]。
蛋白质组(proteome)为一种基因组所表达的全部蛋白质, 即某个生物个体、器官、组织或细胞在特定条件下所表达的全部蛋白质[39]。根据不同的研究目的, 蛋白质组学可分为表达蛋白质组学(expression proteomics)、结构蛋白质组学(structural proteomics)和功能蛋白质组学(functional proteomics)[40]。
蛋白质组学技术在种子老化领域的应用还处于起步阶段, 但其重要性不容忽视, 现阶段已有一些研究人员涉及该领域。如, 使用2-DE和iTRAQ两种方法比较耐贮藏品种和不耐贮藏品种水稻种胚的差异蛋白, 同时将两种水稻进行贮藏, 比较贮藏前后的差异蛋白, 发现了与水稻种子贮藏相关的蛋白, 包括LEA蛋白、DNA损伤修复蛋白、Cupin家族蛋白、谷氧还蛋白和类萌发素蛋白[41]。而另有报道称, 含有VHS、ENTH和ANTH结构域蛋白的上调表达与异戊烯转移酶蛋白的下调表达可能同水稻种子的快速老化有关[42]。对人工老化玉米种子的种胚进行差异蛋白分析发现, 表达有差异的蛋白分别与防御、蛋白质定位和贮藏、转录、合成代谢、能量、细胞生长和分裂相关[43]。白杨(Populus tomentosa)种子老化后的蛋白质组学分析也取得了类似的结果, 表达有显著性差异的蛋白多与代谢、蛋白合成、能量、细胞防御、储藏蛋白相关[44]。从细胞器水平上看, 线粒体是种子老化过程中产生ROS的主要场所, 种子老化时首先出现线粒体的损伤[45, 46], 也有研究认为, 可以利用线粒体蛋白质组学技术研究种子线粒体与老化的关系[47]。
现阶段对基因功能的鉴定, 通常采取过量、减弱或终止某一基因的表达, 观察生物体的功能变化, 推测该基因的功能。基因功能鉴定技术一般可以分为转基因技术(transgenic technology)、基因敲除技术(gene knockout technology)和基因沉默技术(gene silencing technology), 基因沉默技术主要包括反义技术(antisense technology)和RNA干扰技术(RNA interference, RNAi)。
脂质过氧化是种子老化劣变的主要原因, 脂氧合酶(lipoxygenase, LOX)是脂类氧化过程中的关键酶, 催化膜脂中的不饱和脂肪酸发生氧化, 主要底物是亚油酸和亚麻酸, 导致膜脂过氧化。LOX有很多种同工酶, 是一个庞大的基因家族, 不同的基因亚型在植物组织中的分布和作用也不相同, 近年来, 许多研究致力于寻找与种子老化相关的基因亚型。Dipak等[48]首先利用RNAi技术证明了OsLOX1基因表达减少可以使人工老化的水稻种子保持活性, 在一定程度上抑制了老化进程, 之后又发现OsLOX1基因表达降低可以抑制种子储藏过程中类胡萝卜素的降解[49]。黄浩雪[50]从水稻中克隆了OsLOX2基因, 利用农杆菌介导获得了OsLOX2基因过表达水稻及两种干扰的转基因水稻(hpRNAi20-1和hpRNAi25-4), 过表达株系OsLOX2的表达量大约是野生型的2倍, hpRNAi20-1中OsLOX2的表达量是野生型的29%, hpRNAi25-4中OsLOX2的表达量是野生型的5%, 将这些转基因水稻的种子进行人工加速老化, 发现过表达植株的种子发芽率比野生型显著降低, 而在干扰株系中, hpRNAi20-1的发芽率比野生型高, hpRNAi25-4的发芽率比野生型低, 说明一定程度降低OsLOX2的表达可以抑制种子老化, 延长种子的寿命。Bai等[51]利用RNAi技术得到的OsLOX3基因敲减的转基因水稻株系, 人工老化后, 其种子的发芽率比野生型高, 但表型没有明显差异, 说明OsLOX3基因表达降低可以有效抑制种子老化。磷脂酶D(phospholipase D, PLD)能够将膜中的磷脂降解, 参与种子储藏过程中膜的损伤。研究发现, 通过敲除或敲减拟南芥(Arabidopsis thaliana) AtPLDa1基因, 抑制PLD的表达, 可以有效提高储藏后的种子的发芽率和油脂稳定性, 且AtPLDa1基因敲减的种子比AtPLDa1基因敲除的种子更耐储藏, 表明适当降低AtPLDa1的表达可以提高种子的耐贮藏能力[52]。
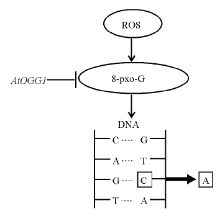
种子贮藏过程中产生的活性氧ROS对基因组的损伤是导致种子老化劣变的重要原因之一, 其中一个显著的DNA损伤是产生8-氧鸟嘌呤核苷(7, 8-dihydro-8-oxoguanine, 8-oxo-G), 8-oxo-G可以在DNA复制过程中将胞嘧啶替换为腺嘌呤, 使GC碱基对转变为AT碱基对, 而拟南芥中的DNA糖苷酶基因AOGG1能够参与碱基对修复, 清除8-oxo-G。AtOGG1定位于细胞核, 过量表达AtOGG1的转基因拟南芥种子中, 8-oxo-G含量较野生型少, 人工控制劣变后转基因种子发芽率较野生型高, 说明AtOGG1通过清除8-oxo-G参与碱基对修复(图1), 提高了种子寿命[53]。多聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase, PARP]是参与DNA修复的核蛋白, 研究发现, 拟南芥中存在3种PARP基因亚型, 其中AtPARP3在种子中表达最多, 他们通过T-DNA插入的方法得到了缺乏AtPARP3的拟南芥突变体植株, 进行人工控制劣变后, 突变体植株的种子较野生型种子发芽延迟, 对不利的储藏条件更敏感[54], 说明AtPARP3对种子贮藏和活力非常重要。
ROS主要包括
热激蛋白(heat shock proteins, HSP)是植物在高于其正常生长温度的条件下合成的新蛋白质, 与植物的高温等非生物胁迫关系密切, 近年来有研究涉及热激蛋白与种子老化的关系。分离自莲(Nelumbo nucifera)的一个小热激蛋白基因NnHSP17.5在拟南芥中异源过表达, 结果发现在人工加速老化后, 转基因拟南芥种子较野生型发芽率高, 且SOD活性较高, 证明了NnHSP17.5过表达有利于提高种子的抗老化能力, 在种子老化过程中起到了一定程度的抑制作用[62]。还有研究利用转基因烟草证明了向日葵(Helianthus annuus)热激转录因子HaHSFA9能够提高小热激蛋白的含量, 提高种子活力[63]。
种子在贮藏过程中发生老化是不可避免的, 引起种子老化的原因有很多, 国内外学者就此开展了大量的研究工作, 但仍旧没有从根本上揭示种子老化的机理。虽然分子生物学技术应用于种子老化研究领域的时间较晚, 但已经十分活跃, 也取得了不小的进展, 其中有关于遗传完整性的研究, 也寻找到了一些老化相关基因, 有待于进一步的鉴定和性状改良。基于现有的研究情况和存在的问题, 关于种子老化机制的研究, 可关注以下几个方面。
1)以往的研究多集中在活性氧自由基和一些老化相关酶的含量变化上, 以后可以加强对相关蛋白或mRNA定位的研究, 在组织水平或亚细胞水平研究种子老化的部位和轨迹。
2)已有一些组学研究初步找出了种子老化相关基因, 其中仅有小部分基因的功能已经得到验证, 但大多数基因仍有待于深入研究, 利用转基因等手段不仅可以在更深层次探究种子老化的机理, 而且有可能延长种子寿命。
3) 种子老化相关基因的功能得到验证后, 需要进一步研究其调控机理以及信号转导途径, 整合形成一个完整的调控网络, 解释种子老化的机制, 并找出更多解决种子老化的办法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|