第一作者:罗昱芬(1990-),女,山东沾化人,在读硕士生,研究方向为牛奶中黄曲霉毒素检测。E-mail:[email protected]
比较了免疫亲和柱-高效液相色谱法(HPLC)和酶联免疫吸附法(ELISA)测定牛乳中黄曲霉毒素B1(AFB1)和M1(AFM1)的回收率、方法检出限及精密度。结果表明,HPLC法测定AFB1、AFM1的检测限分别为0.02和0.01 μg·L-1,ELISA法测定AFB1、AFM1的最低检出限分别为0.05和0.02 μg·L-1;阴性牛乳试样AFB1(0.003、0.006、0.012、0.024 μg·kg-1)和AFM1(0.005、0.01、0.025、0.05 μg·kg-1)的回收率试验表明,HPLC法测定AFB1与AFM1的回收率分别为77.58%~82.81%和77.51%~82.23%,变异系数分别为1.93%和3.51%;ELISA法测定AFB1与AFM1回收率分别为77.28%~79.11%和75.40%~76.34%,变异系数分别为2.20%和3.80%,两种方法测定AFB1的回收率差异不显著( P>0.05),当AFM1添加浓度大于0.025 μg·kg-1时,HPLC法回收率显著高于ELISA法( P<0.05);综上,两种方法灵敏度高、重复性好,HPLC法测定高浓度AFM1时准确性优于ELISA法。
Immunoaffinity column-high performance liquid chromatography (HPLC) and enzyme-linked immunosorbent assay (ELISA) methods were adopted to determine aflatoxins (AF) B1 and M1 in milk. The recovery, detection limit, and precision of these two methods were compared in this study. The results showed that, for HPLC, the detection limits of AFB1 and AFM1 were 0.02 and 0.01 μg·L-1, respectively, while for ELISA, the detection limits of AFB1 and AFM1 were 0.05 and 0.02 μg·L-1, respectively. Standard solutions of AFB1 (0.003, 0.006, 0.012, and 0.024 μg·kg-1) and AFM1 (0.005, 0.01, 0.025, and 0.05 μg·kg-1) were added into blank milk samples and the results of recovery experiments indicated that, for HPLC, the recoveries of AFB1 and AFM1 were 77.58%~82.81% and 77.51%~82.23% with relative standard deviations of 1.93% and 3.51%, respectively. For ELISA, the recoveries of AFB1 and AFM1 were 77.28%~79.11% and 75.40%~76.34% with relative standard deviations of 2.20% and 3.80%, respectively. The recovery of AFB1 did not significantly differ between the two methods ( P>0.05). However, the recovery of AFM1, when the amount added was more than 0.025 μg·kg-1, was significantly higher by HPLC than by ELISA ( P<0.05). In conclusion, both the tested methods were highly accurate, with a high sensitivity and good repeatability. At higher concentrations of AFM1, the accuracy of HPLC was better than that of ELISA.
黄曲霉毒素(aflatoxin, AFT)是主要由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)产生的一类结构相似的有毒真菌代谢物[1, 2], 其基本结构为二呋喃环和香豆素, 前者是产生毒素和致癌的主要结构, 后者对毒性、致癌性起加强作用[3, 4, 5], 能引起严重的肝损伤、肝硬化和肝癌, 伴随免疫抑制效应[6]。根据AFT在紫外光下产生荧光颜色的不同, 将其分为B族和G族两大类及其衍生物, 其中B族发蓝色荧光, G族发绿色荧光[7]。目前已知结构的黄曲霉毒素有B1、B2、B2a、G1、G2、G2a、M1、M2等20余种, 其中AFB1、AFB2、AFG1、AFG2、AFM1和AFM2是最常见的6种毒素[8]。AFB1是所有黄曲霉毒素中最普遍、毒性最强的, 通常污染粮油及其制品、动植物食品, 如花生、花生油、玉米、小麦、豆类、坚果类、棉籽、乳及乳制品、水产品等[9, 10], 被世界卫生组织的国际癌症研究机构认定为主要的致癌物[11]。
AFB1存在于未完全干燥的饲料中, 动物摄入被AFB1污染的饲料后, 在体内肝微粒体单氧化酶系催化作用下, AFB1经过羟基化生成AF
目前, 牛乳及其制品中AFT的检测方法主要有薄层色谱法[17]、酶联免疫测定法(ELISA)[18]、高效液相色谱法(HPLC)[19]及液相色谱串联质谱法[20]等。其中薄层色谱法操作繁琐、灵敏度差、定量不够准确, 已很少使用[21]; 液相色谱串联质谱法检出限低、灵敏度高、线性范围广、简便快捷, 但是仪器价格较为昂贵, 因此应用受到限制。本研究采用免疫亲和柱净化-高效液相色谱荧光检测法及酶联免疫吸附法比较生鲜乳中AFB1和AFM1测定的检出限、线性范围、回收率及重复性, 对两种方法进行比较及评价。
岛津LC-20高效液相色谱仪:配有荧光检测器, 带柱后衍生系统(日本岛津公司); PriboFast黄曲霉毒素B+G+M免疫亲和柱3 mL, 8位泵流操作架, 空气压力泵, 黄曲霉毒素B1、M1测定采用ELISA检测试剂盒(青岛Pribolab有限公司); 3K15冷冻离心机(德国Sigma公司); Bio-Tek ELX800全自动酶标仪(美国宝特公司); 玻璃纤维滤纸(孔径1.5 μ m, 美国Whatman公司); VORTEX KB-3型漩涡混合器(海门市其林贝尔仪器制造有限公司)。
甲醇、乙腈(色谱纯, 国药集团化学试剂有限公司); 柱后衍生碘液; 黄曲霉毒素B1标准工作溶液(0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 μ g· L-1, 青岛Pribolab有限公司), 黄曲霉毒素M1标准工作溶液(0、0.7、1.4、2.8、4.2、5.6、7.0、11.2 μ g· L-1, 青岛Pribolab有限公司); 实验用水(超纯水); 滤膜(0.45 μ m, 北京莱德凯斯科技有限公司)。
1.3.1 高效液相色谱-荧光检测法
1)提取:称取10 g牛奶试样, 精确到0.01 g, 置于50 mL的离心管中, 于8 000 r· min-1、-4 ℃条件下离心15 min, 取下层用玻璃纤维滤纸过滤, 待净化。
2)样品净化:将上述过滤液全部转移到10 mL注射器中, 调节空气压力泵, 使提取液以1~2 mL· min-1流速缓慢通过免疫亲和柱, 直至2~3 mL空气通过柱体。
向上述注射器内加20 mL水淋洗柱子, 弃去全部流出液, 并使2~3 mL空气通过柱体。以2.0 mL色谱甲醇分两步进行重力洗脱, 收集全部洗脱液过0.45 μ m滤膜, 供液相色谱测定。
3)色谱条件:色谱柱为Inertsil ODS-3, 5 μ m, 250 mm × 4.6 mm(内径); 柱温为35 ℃; 进样量100 μ L; 检测器为岛津LC-20荧光检测器; 流速1 mL· min-1; 其它色谱条件如表1所示。
| 表1 AFB1、AFM1色谱测定条件 Table 1 Chromatographic conditions of AFB1 and AFM1 |
4)色谱测定:根据表1所述液相色谱分析条件, 分别对黄曲霉毒素B1、M1标准工作液进行分析, 根据峰保留时间定性, 峰面积外标法定量。以峰面积为纵坐标, 标准工作液浓度(μ g· L-1)为横坐标, 绘制标准工作曲线, 用标准工作曲线对样品进行定量。
1.3.2 酶联免疫吸附法
1)黄曲霉毒素B1的测定
试剂准备:从冰箱中取出黄曲霉毒素B1酶联免疫试剂盒, 平衡至室温, 所有试剂使用前轻轻颠倒摇匀。洗涤工作液:用去离子水将浓缩洗涤液按1∶ 9体积比稀释。样品前处理:称取10 g牛奶试样, 精确到0.01 g, 置于50 mL的离心管中, 于8 000 r· min-1、-4 ℃条件下离心15 min, 弃去脂肪层待测。检测步骤:加AFB1系列标准溶液(0、0.15、0.3、0.6、1.2、2.4 μ g· L-1)或待测样品提取液每孔100 μ L, 并做2孔平行, 随即在各孔中分别加入50 μ L酶标物, 再加入50 μ L试剂液#1, 混匀, 加盖板膜, 室温下反应10 min; 去盖板膜, 甩干孔液, 用洗涤工作液重复洗涤3次, 每次间隔30 s, 拍干后各孔分别加入100 μ L显色液, 加盖板膜, 室温避光反应10 min, 各孔分别加入100 μ L终止液; 终止反应后, 立即用酶标仪在450 nm波长处测定各孔吸光度值, 并绘制标准曲线, 计算样品中的AFB1含量。
2)黄曲霉毒素M1的测定
试剂准备:从冰箱中取出黄曲霉毒素M1酶联免疫试剂盒, 平衡至室温, 所有试剂使用前轻轻颠倒摇匀。洗涤工作液:用去离子水将浓缩洗涤液按1∶ 9体积比进行稀释。标准工作液:用样品稀释液将浓缩标准液按1∶ 9体积比稀释, 稀释后标准液浓度为0、0.01、0.05、0.1、0.5、1 μ g· L-1。样品前处理:称取10 g牛奶试样, 精确到0.01 g, 置于50 mL的离心管中, 于8 000 r· min-1、-4 ℃条件下离心15 min, 弃去脂肪层待测。检测步骤:加AFM1系列标准溶液或待测样品提取液每孔100 μ L, 并做两孔平行, 再加50 μ L试剂液#1, 加盖板膜盖住微孔, 室温下反应60 min; 去盖板膜, 甩干孔液, 用洗涤工作液重复洗涤3次, 每次间隔30 s, 拍干后各孔分别加入100 μ L酶标物, 轻轻混匀, 加盖板膜盖住微孔, 室温下反应60 min后继续洗涤微孔板; 拍干后各孔分别加入100 μ L显色液, 轻轻混匀, 在室温黑暗下反应20 min, 加终止液每孔100 μ L, 终止反应后, 立即用酶标仪在450 nm波长处测定各孔吸光度值, 并绘制标准曲线, 计算样品中的AFM1含量。
采用SPSS 19.0软件对所测数据进行统计分析, 测定结果用平均值± 标准误表示, 对ELISA法和HPLC法所得AFB1、AFM1的回收率进行t检验, 显著性水平为0.05, 采用Origin 10.0绘图软件制图。
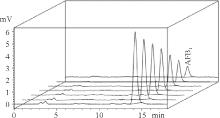
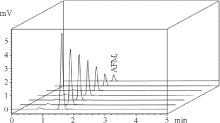
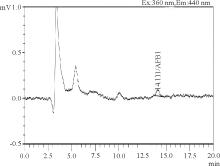
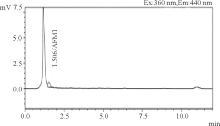
2.1.1 高效液相色谱法 由标准物质色谱图可以看出, 黄曲霉毒素B1、M1参考保留时间分别为14、1.6 min左右(图1、图2); 从加标样品的色谱图可看出, 净化效果良好, 色谱峰峰形较佳, 基本没有杂质峰(图3、图4)。
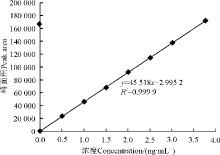
利用AFB1标准储备液配制浓度为 0、0.5、1.0、1.5、2.0、2.5、3.0 、3.5、4.0 μ g· L-1的系列 AFB1 标准溶液, 在表1所述的色谱条件下进样分析。以色谱峰面积对AFB1浓度(μ g· L-1)绘制曲线(图5), 线性回归方程为y=45 518x-2.995 2, 决定系数R2=0.999 9, AFB1在0~4.0 μ g· L-1浓度范围内与峰面积具有良好的线性关系。以荧光检测器的检测信号为基线噪声信号3倍(即信噪比为3︰1)计算相对应的添加浓度, 该浓度即为检测限[22]。确定本方法AFB1检测限为0.02 μ g· L-1。
配制浓度为 0、0.7、1.4、2.8、4.2、5.6、7.0、11.2 μ g· L-1的系列 AFM1标准溶液, 以色谱峰面积对AFM1浓度(μ g· L-1)绘制曲线(图6), 线性回归方程为y=2 941.8x-9.159 8, 决定系数R2=0.999 9, AFM1在0~11.2 μ g· L-1浓度范围内与峰面积具有良好的线性关系, 确定AFM1检测限为0.01 μ g· L-1。
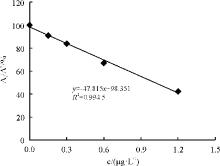
2.1.2 酶联免疫吸附法 配制AFB1系列标准溶液浓度为0、0.15、0.30、0.60、1.20、2.40 μ g· L-1进行ELISA检测, 以百分吸光率(各浓度标准品平均吸光度值与0 μ g· L-1吸光度值的比值, %)为纵坐标, 标准品浓度(μ g· L-1)为横坐标作图(图7), 得回归方程为y=-47.815x+98.351, 决定系数R2=0.994 5, AFB1在0~2.4 μ g· L-1浓度范围内与其百分吸光率的线性关系良好, 通过计算3.3σ /校准曲线的斜率确定ELISA法测定黄曲霉毒素的最低检出限[23], 其中σ 为7条特定校准曲线截距的标准偏差, 每一条特定校准曲线由3个浓度点组成, AFB1的检出限为0.05 μ g· L-1。
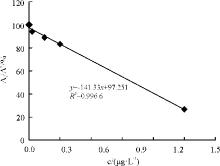
AFM1系列标准溶液浓度为0、0.01、0.05、0.10、0.50、1.00 μ g· L-1, 用与AFB1相同的方法作图(图8), 得回归方程为y=-141.33x+97.251, 决定系数R2=0.996 6, AFM1在0~1 μ g· L-1与其百分吸光率的线性关系良好, AFM1的检出限为0.02 μ g· L-1。
对未检出黄曲霉毒素的阴性牛奶样品进行0.003、0.006、0.012、0.024 μ g· kg-1(AFB1)和0.005、0.010、0.025、0.050 μ g· kg-1(AFM1)4个添加水平回收率试验, 其中0.025 μ g· kg-1 (AFM1)和0.012 μ g· kg-1(AFB1)水平重复测8次, 平均回收率和精密度数据见表2和表3。
以AFB1计, 牛乳样品在添加浓度为0.003、0.006、0.012、0.024 μ g· kg-1时, ELISA法测定的回收率在77.28%~79.11%, HPLC法的回收率在77.58%~82.81%, 两种方法间回收率差异不显著(P> 0.05)(表2); 以AFM1计, 牛乳样品在添加浓度为0.005、0.010、0.025、0.050 μ g· kg-1时, ELISA法测定的回收率在75.40%~76.34%, HPLC法的回收率在77.51%~82.23%, 添加浓度为0.005、0.010 μ g· kg-1时, 两方法间回收率差异不显著(P> 0.05), 而添加浓度为0.025 μ g· kg-1时差异显著(P< 0.05), 添加浓度为0.05 μ g· kg-1时差异极显著(P< 0.01)。ELISA法与HPLC法测定AFB1的变异系数分别为2.20%和1.93%, 测定AFM1的变异系数分别为3.80%和3.51%(表3)。
目前, 测定牛乳中AFB1与M1的相关国家标准有GB/T 23212-2008(牛奶和奶粉中黄曲霉毒素B1、B2、G1、G2、M1、M2的测定复合免疫亲和柱液相色谱-荧光检测法), GB 5413.37-2010(乳和乳制品中黄曲霉毒素M1 的测定)和GB 5009.24-2010(食品中黄曲霉毒素M1 和B1 的测定薄层色谱法), 应用免疫亲和柱进行检测时, 是将黄曲霉毒素特异性抗体交联在柱内固体支持物上, 当提取液通过免疫亲和柱时, 黄曲霉毒素与抗体结合。用水清洗免疫亲和柱, 去除柱内的杂质, 然后用洗脱剂(甲醇等)洗脱吸附在柱上的黄曲霉毒素, 不同厂家免疫亲和柱材料不同, 在产品使用前有必要对其准确度与精密度进行评估。本研究中HPLC法检测AFB1和AFM1的加标回收率分别为77.58%~82.81%和77.51%~82.23%, 相对标准偏差分别为1.93%和3.51%, 检出限分别为0.02和0.01 μ g· L-1, 这与国标GB 5413.37-2010中AFM1的检测结果一致, 也与胡宏灿等[24] 、周贻兵等[25]测得HPLC法对AFM1的加标回收率为68%~85%, 相对标准偏差为2.73%~4.55%, 检出限为0.01 μ g· L-1的结果基本一致, 而AFB1的检测, 本研究所用方法与国标GB/T 23212-2008中免疫亲和柱类型不同, 柱后衍生系统亦有差异, 所以检出限结果差异较大, 但回收率结果一致。上述结果表明, HPLC法测定黄曲霉毒素的精密度和准确度均良好, 但该法样品前处理较为繁琐, 免疫亲和柱消耗多, 检测成本高, 而且AFB1的荧光检测灵敏度较低, 需要增加衍生处理。另外, 该方法需要专业技术人员操作, 所需仪器设备昂贵, 主要应用在专业实验室[26]。
| 表2 牛奶中黄曲霉毒素添加回收率 Table 2 Additive recovery of aflatoxins in milk |
| 表3 两方法的精密度试验结果 Table 3 The repeatability results of two methods |
酶联免疫吸附法(ELISA)是将抗体抗原反应的特异性和酶与底物显色反应的高效催化作用有机结合而成的免疫分析技术[27], 有直接竞争和间接竞争两种模式, 测定牛乳中黄曲霉毒素的ELISA国标测定法目前只有GB 5413.37-2010。卢安根等[28]的研究表明, ELISA法检测牛奶中的AFB1加标回收率为95.0%~104.2%, 相对标准偏差为1.0%~1.6%, 灵敏度为0.03 μ g· L-1; 李平等[29]利用ELISA试剂盒检测牛奶中的AFM1, 得到回收率在93%~120%, 最低检出限为0.039 μ g· L-1; GB 5413.37-2010方法中应用双流向酶联免疫法测定AFM1的检出限为0.5 μ g· kg-1, 而本研究得出ELISA法检测AFB1的回收率为77.28%~79.11%, 检出限为0.05 μ g· L-1, AFM1的回收率为75.40%~76.34%, 检出限为0.02 μ g· L-1。目前虽然ELISA测定方法应用较为广泛, 但由于ELISA法使用的抗体和酶, 牛乳样品基质成分(糖类、脂肪、蛋白质及其它营养物质)均比较复杂, 易受诸多不确定因素影响, 因此不同来源的ELISA试剂盒检测的准确性和精密度会出现差异, 需要在使用前进行方法学评价。
本研究显示, HPLC法与ELISA法测定AFB1 的准确性差异不显著, 但当AFM1添加浓度为0.025 μ g· kg-1时, HPLC法与ELISA法所得回收率数据差异显著, 添加浓度为0.05 μ g· kg-1时, 差异极显著, 说明HPLC法测定高浓度AFM1时准确性优于ELISA法。本研究中采用HPLC法与ELISA法两种方法测定两种毒素的相对标准偏差均在4.0%以内, 准确性、重复性良好, 符合定量检测对相对标准偏差的要求[30]。HPLC法中所用免疫亲和柱在使用前应注意恢复柱温至室温(22~25 ℃), 需多次洗脱以提高回收率, 流动相需要经滤膜过滤并超声脱气, 放置在规定位置逐个排气, 液相检测前必须平衡柱子使基线平稳; ELISA测定样品的前处理过程较简单, 回收率较高, 操作较为简便, 但在操作中需注意实验一旦开始, 后续步骤应连续完成, 在30 min内读取吸光光度值, 且样品和标准品要同时进行操作, 以保证实验条件的一致性, 洗涤微孔过程至关重要, 应迅速甩干以防止微孔间交叉污染。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|