第一作者:李久道(1993-),男,吉林松原人,在读硕士生,主要从事植物抗逆方面的研究。E-mail:[email protected]
我国北方干旱气候和盐渍化土地严重限制了羊草( Leymus chinensis)生长,为探究羊草在逆境下根、叶的联系与区别,为提高羊草耐盐性和耐旱性提供理论依据,本研究通过设置不同浓度PEG(20%、30%、40%、50%)溶液和NaCl溶液(100、200、300、400 mmol·L-1),模拟不同程度干旱和盐生境,测定干旱胁迫和盐胁迫下羊草根、叶抗氧化酶系统(APX、CAT、POD)活性和可溶性蛋白含量的变化,对比羊草根、叶在胁迫下的生理反应。结果显示,轻度盐胁迫下(100 mmol·L-1),羊草主要通过叶片的APX消除活性氧自由基,渗透调节部位主要在叶片中;中度盐胁迫(200、300 mmol·L-1)下,根部、叶部分别主要通过提高POD和CAT活性来消除活性氧;胁迫严重时(400 mmol·L-1),根部APX显著升高,叶片则通过提高POD和CAT活性共同抵抗活性氧的危害,渗透调节也会从叶片转为根、叶共同作用。干旱胁迫初期(20%),羊草主要依靠根、叶中的APX和叶中的CAT来消除活性氧,随着胁迫加重,根中的APX和叶中的CAT活性提高,共同抵抗活性氧危害,根、叶中POD活性一直呈下降状态,对抵抗活性氧自由基伤害作用不大,渗透调节部位主要在叶片中。
The growth of Leymus chinensis was severely restricted by the arid climate and salinized land in north of China. This test contrasts physiological responses of roots and leaves of L. chinensis under stress, to identify the effects on, and differences between, roots and leaves of L. chinensis by simulating different drought and salt conditions. The benefit of this study is to provide a theoretical basis for enhanced salt tolerance and drought tolerance in L. chinensis. Drought stress and salt stress were respectively simulated by different concentrations of PEG solution and NaCl solution. We discuss the activities of antioxidant enzymes (APX, CAT, and POD) and diversification of soluble protein content in the roots and leaves of L. chinensis. Result: Under mild salt stress (100 mmol·L-1), L. chinensis mainly eliminated the ROS through APX of the leaves, and the site of osmotic regulation is mainly in the leaves; under moderate salt stress (200, 300 mmol·L-1), the roots and leaves eliminated ROS by increasing activities of POD and CAT, and the roots mainly improved activity of POD, and the leaves mainly enhanced activity of CAT; under severe stress (400 mmol·L-1), APX of the roots was significantly increased, while the leaves were able to resist damage from ROS by increasing POD and CAT activities, and the location of osmotic regulation also changed from leaves, to roots and leaves. In the early stage of drought stress (20%), L. chinensis mainly relied on APX of roots and leaves and CAT of leaves to eliminate ROS. With the stress increase, activities of APX and CAT in roots were increased to resist the damage from ROS, and the activity of POD in roots and leaves kept decreasing, The location of osmotic adjustment was mainly in leaves.
羊草(Leymus chinensis)是根茎型禾本科多年生牧草, 具有产量高、营养丰富等特点, 且耐盐碱、耐寒、耐旱, 在平原、山坡、沙壤土中均能生长, 在呼伦贝尔草原、松嫩平原和科尔沁草原等草原都有广泛分布[1], 但是这些北方草原的畜牧业生产受到了干旱和盐渍化的困扰和威胁。因此, 干旱、盐渍土壤的生物学治理和综合开发利用及牧草耐盐性、耐旱性的研究具有重要意义。近年来, 关于羊草的抗性研究已经取得诸多成果, 不过关于羊草在受到胁迫时不同部位生理响应的联系和区别还鲜有报道。在盐渍生境中, 植物生长受到盐分离子和许多矿质养分离子之间交互作用的影响, 造成植物体内养分吸收、养分利用和分配的不平衡, 同时植物对必需营养元素的需求也增加[2]。不同部位生长受盐抑制作用不同, 地上部分较根部受抑制明显, 植株各器官中叶对干旱最敏感[3] 。越来越多的研究表明, 活性氧自由基(ROS)是植物生长及抵抗逆境的重要组成部分[4], 在调节光合作用、病原响应、细胞程序性死亡、激素的分泌等生理活动行使着核心信使的功能[5]。但是, ROS也可以通过芬顿反应转化成羟基自由基, 从而产生各种毒性作用影响不同的细胞器[6]。研究表明, 根茎在羊草响应盐胁迫的生理过程中与根系具有类似的功能, 盐胁迫下羊草不同器官同一抗氧化酶对活性氧淬灭具有不同的作用, 与过氧化物酶(POD)相比, 不同器官超氧化物歧化酶(SOD)和过氧化氢酶(CAT)作用可能更大[7]。在对玉米(Zea mays)进行水分胁迫的研究中, 玉米根系、叶片保护酶系SOD、CAT、POD活性均在生长发育前中期显著升高而后期下降, 根系SOD、CAT 和POD活性小于叶片, 膜脂过氧化产物含量随水分胁迫程度加剧而增加, 且根系丙二醛(MDA)含量小于叶片MDA 含量[8]。植株处于逆境时, 二者固有的遗传性关系被打破。叶片和根系间出现了此消彼长的响应关系, 以此达到整体结构与功能的动态平衡[9]。本研究分别设置不同浓度NaCl、PEG模拟盐胁迫和干旱胁迫, 并测定羊草根、叶的抗氧化酶系统(APX、CAT、POD)活性及可溶性蛋白含量, 比较两种胁迫对羊草根、叶的危害特点, 进一步探讨羊草根、叶对逆境胁迫的生理生态适应性, 为改良盐化草地提供理论依据。
试验用吉生1号羊草种子于2015年采自吉林省吉生羊草良种站, 在5 ℃条件下贮藏备用。试验在恒温光照培养箱中进行, 昼夜温度分别设置为30/20 ℃, 光照强度12 000 lx, 13 h光照, 11 h黑暗, 幼苗出土后每天用Hoagland溶液浇透一次, 每盆定苗10株。
分别配制含有100、200、300和400 mmol· L-1浓度NaCl的Hoagland溶液作为盐处理组; 含20%、30%、40%、50%浓度PEG的Hoagland溶液模拟干旱胁迫。在羊草正常生长15 d后, 用含有相应浓度NaCl或PEG的Hoagland溶液分别进行浇灌, 每天早晚分别浇灌150 mL, 处理10 d, 对照组(CK)只浇灌Hoagland溶液。
在最后一次处理后的第2天早晨收样, 小心取出每盆中的所有幼苗植株, 将地上部分与地下部分分开, 称量幼苗的鲜重, 称取羊草幼苗各器官(叶片、根系)鲜重 0.5 g。
加入1 mL磷酸缓冲液(pH 7.8, 0.05 mol· L-1), 液氮研磨, 研磨后再加入4 mL磷酸缓冲液。将研磨液倒入离心管中, 平衡。4 ℃下15 000 r· min-1离心15 min, 离心后冷藏保存用于酶活性测定。
抗坏血酸过氧化物酶(APX)采用邹琦[10]的方法测定; 过氧化物酶(POD)用愈创木酚法测定[10]; 过氧化氢酶(CAT)用紫外吸收法测定[10]; 可溶性蛋白采用考马斯亮蓝法测定[10]。
采用SPSS 19.00软件对所测数据统计分析, 用平均值± 标准误表示测定结果, 分别对羊草根及叶在不同浓度NaCl和PEG下的可溶性蛋白含量、APX、POD、CAT进行单因素方差分析, 并用Duncan法对各测定数据进行多重比较; 采用Excel 2007制图。
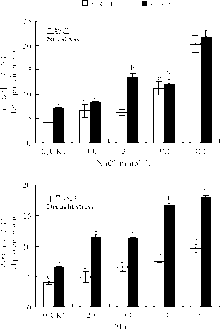
无论是干旱胁迫还是盐胁迫, 羊草根、叶可溶性蛋白含量大部分都显著(P< 0.05)高于对照组(CK), 呈现出随胁迫强度增大而增大的趋势, 并在胁迫强度最大时达到最高, 且在两种胁迫中, 根系可溶性蛋白均低于叶中(图1)。与对照组相比, 盐胁迫根部可溶性蛋白增幅在400 mmol· L-1达到最高, 为386.05%, 叶部同样在此浓度下增幅达到最高, 为201.33%; 干旱胁迫下根部可溶性蛋白增幅为141.36%, 叶部增幅最高为178.49%。
盐胁迫下, 羊草叶片APX活性在100 mmol· L-1时显著提高, 较对照组增加了155.81%(P< 0.05), 同等浓度下根部增幅为89.76%。随着盐浓度的升高, 叶片中APX活性明显下降, 根部APX则呈上升趋势, 在浓度最高时(400 mmol· L-1)活性最强(图2)。
 | 图2 盐胁迫对羊草根、叶抗氧化酶系统的影响Fig.2 Effect of salt stress on antioxidant enzyme system of roots and leaves of Leymus chinensis |
叶部CAT活性在胁迫最强时, 达到最高, 增幅为273.04%, 根部CAT活性变化并无特别规律, 各浓度下CAT活性和增幅均小于叶部。
根部POD活性在胁迫初期(100、200 mmol· L-1)并无显著变化, 在300 mmol· L-1时较0、100、200 mmol· L-1时显著提高, 随着胁迫加重, 在400 mmol· L-1时明显下降, 降到最低水平, 叶部POD活性虽少于根部, 但随胁迫加重, 呈逐渐升高趋势, 在400 mmol· L-1时达到最高, 并超过根部的POD活性(图2)。
干旱胁迫下羊草根、叶APX活性均出现先升高后降低的趋势, 不同的是根部在PEG浓度为40%时达到最高, 增幅为41.71%, 随后降低, 而叶部则是在20%达到最高, 增幅为76.85%, 随后降低至正常水平, 各PEG浓度下根部APX活性均高于叶部(图3)。
根、叶CAT活性在干旱胁迫下均有显著升高, 且根部比叶部活性增幅更大, 为189.40%。
羊草POD活性在干旱胁迫下有明显的下降趋势, 且根、叶POD活性均在PEG浓度最高时(40%)活性降至最低, 叶部降幅为53.35%, 根部降幅为81.05%(图3)。
植物细胞会通过积累可溶性蛋白、脯氨酸等渗透调节物质来抵御逆境条件带来的脱水现象。在干旱胁迫初期, 可溶性蛋白的增加是因为干旱相关蛋白的积累, 而后期减少是因为光合相关蛋白含量降低的缘故[11]。本研究中, 羊草根、叶可溶性蛋白含量与PEG浓度正相关, 说明在渗透胁迫导致水势降低的情况下, 叶片和根系通过增加可溶性蛋白含量提高吸水能力, 增强细胞渗透调节、维持幼苗正常生长所需膨压[12]。但根部蛋白含量和增幅均小于叶片, 表明干旱情况下渗透调节的主要部位是叶片。在对大豆(Glycine max)进行耐盐性分析时发现, 根中蛋白个数多于叶中的有解毒、信号转导、碳水化合物代谢、氨基酸及氮代谢、蛋白水解、次生代谢物的合成及抗营养因子; 在叶中发现蛋白个数多于根中的只有能量代谢、蛋白合成、蛋白折叠及组装和骨架及细胞壁合成, 根比叶的蛋白组更敏感[13]。本研究中, 高浓度盐胁迫下, 根、叶可溶性蛋白均显著增加, 根系蛋白含量略少于叶部, 但增幅较叶部更高, 说明在盐胁迫较轻时叶部为主要的渗透调节部位, 随着盐胁迫强度增大, 根部分泌的各种功能性蛋白增多, 渗透调节转变为叶片与根部共同作用。
本研究中, 羊草根和叶POD、APX、CAT 3种酶在不同浓度盐胁迫下呈现出不同趋势。在100、200 mmol· L-1NaCl胁迫下, NHC(NeuHy Crested Wheatgrass)牧草会将Na+截留在根部, 减轻离子对叶片的伤害, 随着胁迫升高, Na+增多, 根系质膜被破坏, Na+向叶片转移, 抑制K+吸收, 使牧草生理代谢紊乱[14]。在盐胁迫条件下, 根系APX活性稳定上升, 在胁迫最重时活性最高, 说明根部主要通过APX来清除活性氧自由基, 叶中APX的应答则更为敏感, 在胁迫较轻的时候叶中APX活性显著升高, 随着胁迫加重, 活性下降至正常水平, 可能叶片中其它抗氧化剂如类胡萝卜素、抗坏血酸等活性升高, 清除活性氧, 导致APX活性下降; 在CAT活性方面, 根和叶虽然都是升高趋势, 但随盐浓度增大叶的增幅更大, 叶片中的叶绿体可能是感受盐胁迫最敏感的细胞器, 盐胁迫使叶绿体内膜结构紊乱, 导致光合作用中间产物H2O2积累更多, 使叶中CAT活性比根中更高; POD在根叶中的变化出现了差异, 根部在前中期POD活性升高, 随后下降, 叶部一直呈上升趋势, 说明胁迫较轻时POD主要在根部消除活性氧自由基, 随着胁迫加重, 超过根部细胞所能承受的阈值, 导致其生理活动在300 mmol· L-1时出现下降, 此时叶部细胞在胁迫最大时POD活性达到最高, 帮助羊草抵抗盐胁迫的侵害。
相对于盐胁迫, 羊草的干旱胁迫少了Na+和Cl-的影响, 二者抗氧化酶体系的变化也不尽相同。有研究显示, 在干旱胁迫下, 可溶性蛋白含量呈现出快速下降然后缓慢升高的趋势, SOD活性和CAT活性较无胁迫对照显著增加, POD活性与对照差异显著, 3种酶在抵御干旱方面共同发挥作用[15]。在本研究中, 羊草不同部位感受胁迫时APX、POD、CAT 3种酶具有不同的响应, 且同一抗氧化酶对不同器官活性氧的淬灭具有不同的作用。根系是干旱胁迫首要影响的部位, 根部APX活性随干旱强度的增大而增大, 在胁迫浓度最高时, 根、叶APX活性均显著降低, 叶片仅在轻度胁迫下有明显升高, 且活性小于根部, 说明APX清除活性氧自由基的主要场所在根部, 叶片可以通过蒸腾作用及其它抗氧化剂来抵抗干旱造成的胁迫, 导致APX活性较低, 也有可能是干旱胁迫过重, 破坏了叶片中APX酶分泌表达体系, 导致其活性初期上升后期下降; 根和叶的CAT活性在干旱胁迫下有显著提高, 叶部上升幅度比根部更高, 可能是叶部Ca2+跨膜流动和胞质内钙库的释放增强了CAT活性[16], 抑制活性氧自由基和过氧化氢的产生, 因此成为CAT主要分泌场所; POD活性则呈现出明显的下降趋势, 根部降幅比叶部更大, 表明随着干旱胁迫程度增加, 细胞抗氧化能力减弱, 根系质膜氧化伤害程度增加, 根部活力下降更快, 对干旱适应能力出现明显下降。
轻度盐胁迫下, 羊草主要通过根、叶中的APX抵抗ROS伤害, 在胁迫加重后, 叶中的抗氧化物酶从APX变为CAT和POD抵抗ROS伤害, 根部变为APX和POD共同作用。干旱胁迫初期, APX和CAT为羊草根、叶的主要抗氧化物酶, 随着胁迫加重, 根部抗氧化物酶变为APX, 叶部变为CAT, 干旱对根部的CAT和叶部的APX有显著影响, POD活性则呈下降状态, 下降原因有待进一步探究。可溶性蛋白方面, 随着盐胁迫的加重, 渗透调节部位会从叶片变为根、叶共同调节; 干旱胁迫下根、叶可溶性蛋白均有显著增加, 但调节部位以叶片为主。
(责任编辑 武艳培)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|