为了探测大气氮沉降对高山草甸的影响,设置对照(N0)、低氮14.3 g·m-2(N5)、中氮28.6 g·m-2(N10)和高氮57.1 g·m-2(N20)4个氮素(NH4NO3)添加水平,连续3年对青藏高原东部的高山草甸群落进行施氮处理,测定各添加水平下群落生物量及物种多样性的变化。结果表明,随着氮素添加量的增加,地上生物量逐渐增加,在N20达到最大,且地上生物量在空间格局上呈现向上转移的趋势;随氮素的增加,地下生物量先增大后减小,在N10最大,且有向浅层表土(0-10 cm深度)转移的趋势。各功能群中,禾草类植物的地上生物量从N0到N20逐渐增加,在 N20达到最大,其在地上总生物量中所占的比例也在N20达到最大。另外,随着施氮量的增加,植物物种多样性呈现出逐渐降低的趋势。可以看出,氮素添加对高山草甸群落的结构有着明显的影响。
In order to explore the effects of air nitrogen deposition on alpine meadows, four nitrogen levels (N0, 0; N5, 14.3 g·m-2; N10, 28.6 g·m-2; N20, 57.1 g·m-2) were established in alpine meadows in the eastern Tibetan Plateau, and the biomass and species diversity for each level were measured after three consecutive years of nitrogen addition. The aboveground biomass increased from N0 to N20, reaching the maximal value at N20. Regarding the spatial pattern, the aboveground biomass showed a trend of upward shift, that is, the plants grew taller. The belowground biomass increased initially but decreased afterwards as nitrogen addition increased, peaking at N10, and it showed a trend of shifting towards topsoil (0-10 cm depth). Among the three functional groups (grass, sedge and forbs), aboveground biomass of grass increased from N0 to N20, peaking at 20, and so did the ratio between the aboveground biomass and total aboveground biomass of grass. In addition, plant species diversity decreased gradually as nitrogen addition increased. In conclusion, nitrogen addition exerted an evident influence on the structure of alpine meadows.
20世纪以来, 人类大量燃烧化石燃料、农田大范围施用含氮化肥以及畜牧业的大规模发展, 使得大气中的含氮化合物增多, 引起大气氮沉降的明显增加[1]。中国作为世界三大氮沉降集中区之一, 预计到2050年人为活性氮年排放量将达到2.0× 1011 kg[2]。伴随着氮沉降的大量增加, 土壤的营养成分将发生改变。当土壤营养成分发生改变时, 植物物种在群落中所处的竞争地位将随之改变, 从而影响群落的生物量[3], 特别是土壤中限制性营养成分改变时, 这种影响表现得更为明显[4]。氮素是许多生态系统中植物生长的限制因子之一[5, 6], 对植物的生活史过程有着十分重要的作用[7, 8]。在草原群落中的研究就显示, 氮素添加可以促进某些植物的快速生长和其生物量的积累, 增加植被高度和盖度, 降低群落的物种多样性, 改变群落的结构[9, 10, 11], 还可以提高植物光合能力, 延缓叶片的衰老等[12]。
在青藏高原存在着广阔的高山草甸, 其产草量的高低对当地畜牧业的发展有着举足轻重的作用[13], 同时该区还是对全球气候变化十分敏感的区域[14, 15, 16], 该区草甸群落结构的改变势必影响到生态系统的稳定性。那么, 大气氮沉降升高会给该区高山草甸带来怎样的影响呢?过去的研究, 有针对环境中呼吸作用的, 如有人认为氮素添加可显著抑制土壤呼吸[17], 也有人认为氮素添加可以促进生态系统呼吸, 从而增加生态系统中的碳排放[18]; 在群落特征方面只有少量的研究, 如氮素添加可增加植被盖度、减少植被透光率[19], 可以增加植物群落的高度及地上鲜重[20]。为此, 以青藏高原东部的岷江源头地区为研究地点, 进行人工氮素添加试验, 探讨氮素增加对草地群落特征的影响, 为大气氮沉降增高背景下该区退化生态系统的恢复与重建提供科学依据, 并以期解决以下科学问题:1)在大气氮沉降不断增加的条件下, 高山草甸群落的地上、地下生物量如何变化?2)高山草甸群落的植物物种多样性怎样变化?
研究地位于岷江源头地区的四川省松潘县章腊乡卡卡山(32° 59' N, 103° 40' E), 该地区年均温为2.8 ℃, 1月均温-7.6 ℃, 7月均温9.7 ℃, 年降水量为634.8 mm, 其中的72%发生在6月-8月的夏季[21, 22, 23]。土壤类型为黑毡土, 经测定, 土壤pH 5.46, 有机碳含量49.4 g· kg-1, 总氮含量4.2 g· kg-1, 可溶性氮(铵态氮和硝态氮)19.2 mg· kg-1。卡卡山海拔为4 000 m左右, 在3 800 m以上分布着禾草草甸及杂类草草甸等群落类型, 主要的植物物种有羊茅(Festuca ovina)、紫羊茅(F. ovina)、针茅(Stipa capillacea)、异针茅(S. aliena)、溚草(Koeleria cristata)、垂穗披碱草(Elymus nutans)、中华早熟禾(Poa sinattenuata)、四川嵩草(Kobresia setchwanensis)、高山嵩草(K. pygmaea)、珠芽蓼(Polygonum viviparum)、圆穗蓼(Polygonum sphaerostachyum)、长叶火绒草(Leontopodium longifolium)、淡黄香青(Anaphalis flavescens)、高原毛茛(Ranunculus brotherusii)、美丽风毛菊(Saussurea superba)等。
2012年的7月中旬, 在卡卡山北坡海拔3 860 m左右的草甸群落中, 设置一个45 m(长)× 15 m(宽)的水平样地(选择样地时注意样地内的群落及小地形相对一致), 在样地周围设置铁丝围栏以防人畜干扰。在样地中设置2.5 m× 2.5 m样方12个, 分为上、下两排, 每排6个, 样方行间距均为5 m, 各样方与样地边界的距离为2.5 m(图1)。参照前人在研究草地群落时的氮素添加标准[10, 24, 25], 设置施肥单因素处理共4个水平, 从低到高依次为0(对照, 不施氮)、5、10和20 g· (m2· a)-1, 分别简记为N0、N5、N10和N20, 每个水平3个重复(即3个样方)。同一水平的3个样方在样地中不能同处一排, 也不能上下左右两两相邻, 以使各水平的样方间相对均匀地分散开, 所有样方作好编号。在每个2.5 m× 2.5 m的样方中, 于其中心和近四角处呈梅花形设置5个0.5 m× 0.5 m的小样方并做标记, 用于调查物种多样性、测定群落生物量等群落学特征。
在2013、2014和2015年的5月上旬植物开始萌动生长之前进行氮素添加, 采用NH4NO3作为氮源, NH4NO3中氮素的含量为35%, 照此百分含量计算4个水平各自对应的NH4NO3施用量(表1)。在添加NH4NO3时, 用3 L水将肥料溶解为溶液, 然后用喷壶一次性将溶液均匀地洒在各样方内即可, 对照只喷洒3 L水。喷洒溶液时样方用1 m高的纸板临时分隔开, 以防喷氮素时对邻近样方造成干扰。
| 表1 各水平NH4NO3施用量 Table 1 Application amount of ammonium nitrate in all treatment levels |
1.3.1 群落植物多样性的测定 于2015年7月中旬植物生长旺盛期在小样方中调查植物多样性, 包括植物的种类及个体数。
物种多样性采用两个指标衡量:即物种丰富度(S)和Shannon-Wiener指数(H')。S=出现在样方内的物种数; H'=
1.3.2 群落生物量的测定 生物量于2015年的8月中旬在小样方中进行。生物量的测定分为地上生物量与地下生物量两部分。地上生物量采用收割法测定, 即地上部分齐地刈割, 按功能群分开, 并分成0-10、10-20、20-30、> 30 cm共4个高度层次, 放入信封袋中并做好编号。植物功能群分为3个, 即禾草类、莎草类和杂类草, 测定指标包括各功能群的地上分层生物量、各功能群地上生物量及各功能群在群落地上总生物量中所占的比例。采用土柱法测定地下生物量, 即用一个人工定制的内径10 cm、长度50 cm的圆铁筒来测定地下根系生物量, 圆铁筒外面有刻度, 朝上的一端焊有长的铁把手便于圆筒打入土中后转动圆筒和拔出圆筒。将圆铁筒用铁锤垂直打入地面, 深度为40 cm, 然后将圆铁筒内的圆柱形土块取出, 分成4个土层深度:地面下0-10、10-20、20-30以及30-40 cm, 各层次土壤分开后放在细筛中用清水洗净并拣出其中的石砾, 同样放入事先准备好的大信封袋中并进行编号。在每个0.5 m× 0.5 m的梅花型小样方中, 用圆铁筒随机取3次, 作为这个小样方的地下生物量的代表值。将所有的信封袋(装地上生物量与地下生物量)带回实验室, 置于65 ℃恒温箱中烘48 h, 然后用万分之一电子天平(型号:FA1004)称量, 并作好记录。
用SPSS 17.0对氮素添加对植物多样性和群落生物量的影响进行单因素方差分析(one-way ANOVA), 并采用SSR检验法进行多重比较, 数据以“ 平均数± 标准误” 表示。
随着施氮量的增加, 群落的地上生物量呈现出逐渐增加的趋势, 低氮(N5)、中氮(N10)和高氮(N20)较对照(N0)分别增加了10.2%、22.7%和24.7%, 但添加的氮量到中氮(N10)水平后, 再继续加大氮量(如N20), 地上生物量的增加却不明显(P> 0.05), 而是趋于稳定(表2)。地下生物量的变化趋势有所不同, 随着施氮量的增加, 表现为先显著增加后显著降低, 在N10水平上最大。N0、N5和N10之间的地下生物量差异显著(P< 0.05), 但N0和N20之间差异不显著(P> 0.05)。随着施氮量的增加, 总生物量也呈现出先增加后降低的趋势, 以中氮(N10)水平最大, 较对照(N0)增加了24.7%(P< 0.05)(表2)。
| 表2 氮素添加对高寒草甸生物量的影响 Table 2 Effect of nitrogen application on biomass in alpine meadow |
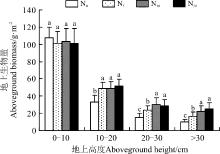
2.2.1 地上生物量的空间分布格局 在0-10 cm高度范围内, 生物量介于101~107 g· m-2, 且各水平间差异不显著(P> 0.05)。在10-20 cm高度范围内, 生物量介于33~52 g· m-2, 且随着施氮量的增加而增加, 各施氮处理均显著高于对照(P< 0.05), 但3个施氮水平之间的差异不显著(P> 0.05)(图2)。在20-30 cm高度范围内, N5、N10和N20的地上生物量较对照分别显著增加了59.1%、104.0%和93.9%。在> 30 cm的高度范围内, N5、N10和N20的地上生物量较对照分别显著增加了65.6%、125.3%和150.5%。可以看出, 随着施氮的增加, 地上生物量在向更高空间上转移, 显然植物有长得更高的趋势。但无论在哪个氮素水平上, 地上生物量仍然是以0-10 cm地上高度为主。
2.2.2 地下生物量的空间分布格局 0-10 cm土层, 随着氮素的增加, 生物量呈先增加后降低的趋势, 在N10水平达到最大, 为1 818.9 g· m-2, 比对照高695.2 g· m-2(P< 0.05); 在N20水平, 虽然0-10 cm土层的生物量有所回落, 但仍然比对照高336.1 g· m-2(P< 0.05)(图3)。在10-20、20-30及30-40 cm土层, 生物量的值从对照(N0)到高氮(N20), 也表现出先升高后降低的趋势, N20最低, 最大值均出现在N5水平上。
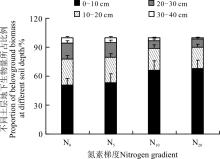
另外, 从土层的生物量在地下总生物量中所占的比例来看(图4), 随着氮素的增加, 0-10 cm土层生物量所占的比例逐渐增大, 从N0的51%到N20的68%, 增加了33.3%。而更深土层的生物量在地下总生物量中所占比例则呈现出逐渐减小的趋势, 如10-20 cm土层, 从N0的26.8%下降到N20的21.7%, 下降了19.0%; 20-30 cm土层, 从N0的16.7%下降到N20的8.7%, 下降47.9%; 而在30-40 cm土层, 则从N0的5.5%下降到N20的1.6%, 下降了70.9%。显然, 在施肥以后地下生物量有向浅层表土转移的趋势。
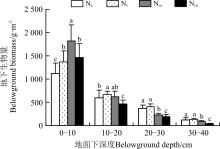 | 图3 施氮对地下生物量分布格局的影响Fig. 3 Effect of nitrogen application on distribution pattern of belowground biomass |
随着施氮量的增加, 禾草类植物的地上生物量增加, N20较对照(N0)增加了85.3%, 且各施氮水平均显著高于对照(P< 0.05)(图5)。莎草类和杂类草的地上生物量在各水平之间虽有一定的变化, 但差异不显著(P> 0.05)。
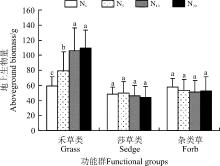 | 图5 施氮对不同功能群地上生物量的影响Fig. 5 Effect of nitrogen application on aboveground biomass in different functional groups |
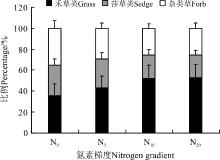
从各功能群在地上总生物量中所占的比例来看(图6), 随着氮素水平的提高, 禾草类所占的百分比例也在提高, 从N0的35.8%上升到N20的53.2%, 上升了48.6%。同时, 莎草类和杂类草有一定程度的降低, 莎草类从N0到N20降低了8.0个百分点, 杂类草从N0到N20降低了9.3个百分点(图6)。
随着施氮量的增加, 物种多样性呈现逐渐降低的趋势, 但各施氮水平降低的幅度并不相同。从低氮(N5)到中氮(N10), 物种丰富度(S)和香农指数(H')分别显著降低了18.2%和12.5%(P< 0.05); 从中氮(N10)到高氮(N20), 二者又分别显著降低了17.8%和10.7%(P< 0.05); 从对照(N0)到低氮(N5), 二者略有降低(P> 0.05)(表3)。
| 表3 各施氮水平之间物种多样性的比较 Table 3 Comparison of species diversity under different nitrogen application levels |
氮素对植物的生长和发育起着重要作用, 大气氮沉降的增加对环境中植物的影响取决于环境中氮量的多少。在氮素相对不足的环境中, 氮的输入会促进植物的生长, 提高生产力, 增加生物量的积累[26]; 不过, 长时间的氮素输入使植物生长量减小[27]; 在氮饱和的生态系统, 氮的输入还会抑制植物的生长, 降低生物量的积累[28]。在青藏高原东部, 高山草甸土壤中的总氮含量可以达到4.2 g· kg-1, 然而可溶性的氮所占的比例十分低, 只有19.2 mg· kg-1, 相当于总氮含量的0.46%[29]。可溶性氮含量低主要是受高山环境中低温的影响, 低温使得高山草甸土壤有机氮矿化速率较低的缘故。由于矿化速度低, 高山生态系统中的氮素相对较为缺乏, 植物生长往往受到无机氮的限制。本研究地点所在的岷江上游地区, 属于青藏高原东缘, 其高山草甸群落的生物量在氮素添加后有了较大的增加, 也说明了该区生态系统是受氮素缺乏的限制。在氮素缺乏的系统中, 添加氮素能够增加生物量的原因在于, 氮素是蛋白质和氨基酸合成的重要原料, 氮素添加后, 植物体中的各种酶尤其是与光合作用有关的酶的合成增加, 光合效率提高, 光合产物增加。
有研究认为, 氮素的添加能显著增加禾草类的绝对生物量及其在群落总生物量中所占的比例, 而杂类草在总生物量中所占的比例却降低[30, 31]。本研究得出的结论与上述研究一致。其原因是在青藏高原东部高山草甸群落中, 禾草类植物在氮素添加后个体数明显增多, 在资源竞争中明显居于有利地位, 而其它类群的植物个体数减少, 故而禾本科类生物量加大。另外, 在野外调查中发现, 禾本科中的部分个体, 其高度相对于其它类群的植物高大一些, 在草甸群落中往往占据上层, 可以获取更多的光源, 在氮素和水分充足时可以更快生长。相对而言, 莎草类及杂类草中无植株高度上的优势, 往往占据草甸群落的下层, 在光源的竞争中处于劣势, 即使水、氮等因素充足, 其生长也有限。
还有研究认为, 氮输入会改变植物生物量分配格局, 使地上部分枝叶的含氮量增多, 生物量分配增加, 而根系的生物量则相对减小[24, 32]。与此一致, 本研究中地上生物量也随着施氮量的增加而增加; 但不同的是, 本研究中地下生物量并未随施氮量的增加而减少, 而是呈现出先增加后减少的趋势(表2), 其原因可能是, 在氮素相对缺乏的青藏高原东部, 由于施氮使环境中的氮素变得相对充足, 地上枝叶增多, 会产生更多的营养物质运送至根系部分, 从而有效地促进根系的生长; 不过, 随着施氮量的进一步增加, 植物地上部分的增长趋于稳定, 再增加的氮量已经超过了植物能够利用的范围, 这时过多的氮量反而对根的生长起到抑制作用, 故而根系生物量表现为相对下降。尽管随着施氮量的增加, 地上生物量会有所增加, 但所有氮素水平的地下生物量与地上生物量之比值均在10以上, 这说明高山草甸群落中的植物有着极为发达的根系。另外, 随着施氮量的增加, 地下生物量还表现出了明显的空间格局重新分布, 表土层(0-10 cm)中根系生物量所占比例趋于增加, 这说明在表土施氮量增加时, 根系的向氮性表现明显。另外, 本研究中, 随着施氮量的增加, 地上生物量的空间分布格局也发生了较大的变化, 表现为生物量向上转移, 这除了跟群落中的植物整体长高有关外, 更大程度上还跟禾草类植物快速生长有关, 禾草类植物个体数及高度的较快增加, 是引起地上生物量分布格局变化的重要原因, 也是其生物量在地上总生物量中所占比例增大的原因。
在本研究中, 随着氮素水平的上升, 物种多样性表现出下降的趋势。施肥后多样性降低的原因是土壤可溶性氮素含量的增加, 使得原群落中的优势物种可以更充分地利用营养资源进行生长, 其个体数更多, 植物更高大, 从而更加挤压原群落中优势度小的物种的生存空间, 造成后者个体数减少或从群落中消失。从本研究中群落的实际情况来看, 禾本科植物在3年的氮素添加后植株密度增加, 个体数加大, 而杂类草和莎草科植株相对减少, 有些种类甚至消失, 这跟各功能群植物根系发达程度及对某些营养物质利用效率的高低差异有关。这说明环境条件对物种的选择作用是明显的, 也是迅速的。其他学者对高山苔原和草地群落的研究[33, 34]也得出了与本研究类似的结果。
在青藏高原东部的高山草甸群落中, 施氮量的增加, 可以使地上生物量增加和地下生物量先增加后减少, 还可以使地上生物量向上转移, 使地下生物量向表层土转移。禾草类植物呈现出相对加速生长, 这是地上生物量空间分布格局发生变化的重要原因。另外, 随着施氮量的增加, 物种多样性呈现出逐渐降低的趋势。总之, 氮素添加对高山草甸群落的结构有着明显的影响。
(责任编辑 武艳培)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|