第一作者:李志忠(1963-),男,甘肃靖远人,教授,硕士,主要从事生物化学与分子生物学研究。E-mail:[email protected]
通过形态特征、生理生化特性及16S rRNA序列分析方法对玉米( Zea mays)秸秆和白菜( Brassica pekinensis)尾菜混贮料中的乳酸菌多样性进行分析,并以温度和pH为限制因素筛选优良乳酸菌菌株。结果表明,分离得到的12株乳酸菌分属于乳杆菌属( Lactobacillus)和片球菌属( Pediococcus)。其中,1株(LB-1)为植物乳杆菌( Lactobacillus plantarum),6株(LB-2、LB-4、LB-7、LB-8、LB-9和LB-11)为戊糖片球菌( Pediococcus pentosaceus),3株(LB-5、LB-6和LB-12)为短乳杆菌( Lactobacillus brevis),2株(LB-3和LB-10)为类干酪乳杆菌( Lactobacillus paracasei)。菌株LB-3和LB-8表现出优良的耐高温、耐酸碱特性,且具有较强的产乳酸能力,二者可作为青贮饲料的乳酸菌添加剂。
Morphological observation, physiological and biochemical tests, and the 16S rRNA sequence analysis methods were used to analyse lactic acid bacteria (LAB) diversity in mixed silage of corn stover and cabbage, and the thermotolerant strains were screened through with temperature and pH as the restrictive indicators. The results showed that 12 LAB strains were isolated from mixed silage, which were classified into Lactobacillus and Pediococcus, respectively. Specifically, one strain (LB-1) was Lactobacillus plantarum, six strains (LB-2, LB-4, LB-7, LB-8, LB-9 and LB-11) were Pediococcus pentosaceus, three strains (LB-5, LB-6 and LB-12) were Lactobacillus brevis, and two strains (LB-3 and LB-10) were Lactobacillus paracasei. The characteristics of LB-3 and LB-8 included high-temperature resistance, acid-resistance and higher acid-production ability. Therefore, these two lactic acid bacteria can be used as inoculants for silage forage.
随着我国粮食种植面积和蔬菜生产规模的扩大, 农作物秸秆、尾菜等农业废弃物资源量逐年增加。作物秸秆和尾菜均含有丰富的有机质成分, 二者的季节性“ 爆炸” 产出导致其在短期内难以全部资源化利用(如饲料化、能源化等), 容易给生态环境带来严重危害, 如大量尾菜丢弃堆积常发生腐烂酸臭、细菌滋生等现象; 秸秆焚烧造成大气污染等危害。在我国大多地区, 作物秸秆通常萎蔫或干黄后才收获, 水分和糖分的大量流失使其无法直接青贮。有学者研究发现, 作物秸秆与花椰菜(Brassica oleracea var. botrytis Linnaeus)、白菜(Brassica pekinensis)、高丹草(Sorghum bicolor× S. sudanense)、白花草木樨(Melilotus albus)等含水量高的植物进行混贮, 能够调制出高品质的动物饲料[1, 2, 3, 4]。另一方面, 我国作物秸秆混贮多选择在秋末冬初鲜草不足前进行, 这对缓解冬季饲料供应紧张具有重要意义。但相对秋冬季节而言, 夏秋季节的尾菜污染防治和秸秆饲料调制也有一定必要性。尾菜中富含水分和糖分, 利用青贮原理将秸秆与尾菜进行混合贮存, 既能利用尾菜资源、消除尾菜带来的环境污染, 又能调制出高品质的秸秆饲料, 这对减少秸秆焚烧、加快秸秆饲料化利用、有效治理尾菜污染均具有积极意义[1]。
青贮发酵过程中乳酸菌的种类、数量及其产酸能力大小是决定贮存发酵品质的重要因素, 因此了解混贮过程中的乳酸菌多样性很有必要。同时, 乳酸菌也是常用的细菌发酵促进剂, 添加乳酸菌能增加原料的乳酸菌数量, 促进乳酸发酵, 降低混贮料pH, 抑制有害微生物生长, 从而提高混贮品质[5]。乳酸菌的一般生长温度范围是5~55 ℃, 最适生长温度为30~40 ℃, 温度过高或过低都会影响其生长和发酵品质[6]。高温条件(45~55 ℃)接种乳酸菌不能提高贮存发酵品质, 低温条件(5~15 ℃)下乳酸菌发酵和pH下降缓慢, 需要较长时间才能抑制有害微生物, 因此筛选耐高温或耐低温的乳酸菌株十分重要[7]。近年来, 许多学者就青贮用耐低温乳酸菌的筛选和理化特性进行了报道[8, 9], 而有关耐高温乳酸菌的报道相对较少。
兰州市和武威市是甘肃省高原夏菜的主产区, 年均尾菜产量高达300万t[1]。为进一步减缓夏秋季节的尾菜污染, 促进秸秆资源的饲料化利用, 本研究选取含水量高、产量大的废弃白菜和玉米秸秆进行混合贮存, 通过生理生化试验和16S rRNA序列分析等方法探明混贮料中的乳酸菌多样性, 并以温度和pH为限制因素分离筛选耐高温、高产乳酸优良菌株, 为夏秋高温季节玉米秸秆和尾菜的混贮饲料调制提供可用的乳酸菌添加剂。
液体MRS培养基:蛋白胨10 g; 葡萄糖20 g; 牛肉膏10 g; 酵母浸膏5 g; 吐温-80 1 g; 柠檬酸氢二氨2 g; 乙酸钠5 g; 硫酸镁0.1 g; 硫酸锰0.05 g; 磷酸氢二钾2 g, 加蒸馏水至1 000 mL, 固体培养基添加琼脂15 g。
细菌基因组DNA提取试剂盒:美国Biomiga公司; 2× Taq MasterMix:上海美吉生物医药科技有限公司; DNA Marker-D:上海生工生物工程股份有限公司。
1.2.1 乳酸菌的分离、纯化与鉴定 玉米秸秆和白菜的混合青贮样品为兰州理工大学生物质资源转化利用实验室自制, 其中秸秆和白菜分别切成1~2 cm长和2 cm× 2 cm大小, 按照21∶ 27质量比例混匀, 密闭贮存60 d后进行乳酸菌的分离与鉴定[1]。在无菌环境中取混合青贮样品25 g加入装有225 mL无菌水的锥形瓶中, 室温振荡2 h后菌悬液进行梯度稀释, 然后各取0.2 mL分别涂布于MRS固体培养基上, 37 ℃厌氧培养48 h。挑取不同的典型单菌落进行分离纯化, 结合菌落形态观察、革兰氏染色、过氧化氢酶试验、生理生化特性检测、分子生物学方法进行综合鉴定[1, 10]。
1.2.2 耐高温、高产乳酸菌株的筛选 将上述分离鉴定得到的菌株分别接种于MRS液体培养基中, 37 ℃厌氧培养, 每隔3 h测OD值绘制生长曲线并在48 h后测各菌株的乳酸浓度, 初步筛选生长速度快、乳酸产量高的菌株。进一步考察初筛菌株分别在不同温度(20、30、37、42和50 ℃)和pH(3.5、4.5、5.5、6.5、7.5和8.5)条件下连续培养48 h时的OD值和乳酸浓度, 筛选耐高温且具有一定耐酸性的优良乳酸菌株。乳酸浓度测定采用SBA-40X三通道生物传感分析仪测定。
用Excel软件绘制图表, 并用SPSS 20软件对不同温度和pH处理的OD值和乳酸浓度进行方差分析和Duncan多重比较。
根据菌落形态观察, 挑选乳白色、中央凸起、表面光滑的菌落, 革兰氏染色为阳性和过氧化氢酶试验为阴性的菌落初步判定为乳酸菌, 共分离得到12株, 编号分别为LB-1、LB-2、LB-3、LB-4、LB-5、LB-6、LB-7、LB-8、LB-9、LB-10、LB-11、LB-12。12株乳酸菌的生理生化特性试验结果如表1和表2所示。
各菌株硝酸盐还原和明胶液化试验均为阴性, 且都能在pH 4.5条件下正常生长(表1)。所有菌株均不产生吲哚, 且硫化氢不产气。菌株LB-1、LB-3、LB-5、LB-6、LB-10、LB-12初步认定为乳杆菌属(Lactobacillus)。LB-2、LB-4、LB-7、LB-8、LB-9、LB-11初步认定为片球菌属(Pediococcus)。由糖发酵试验结果可知(表2), LB-1能利用葡萄糖产酸但不产气, 不能水解精氨酸, 除阿拉伯糖、鼠李糖、海藻糖和木糖外的其它糖类和醇类均能进行发酵, 初步认定为植物乳杆菌(Lactobacillus plantarum); LB-2、LB-4、LB-7、LB-8、LB-9、LB-11为球菌, 可以发酵阿拉伯糖、果糖、半乳糖、麦芽糖、甘露糖、水杨苷、海藻糖、纤维二糖, 其生理生化性状与片球菌属相似, 初步鉴定为戊糖片球菌(Pediococcus pentosaceus), 与陶雅等[11]鉴定戊糖片球菌的结果一致; LB-5、LB-6、LB-12可水解精氨酸, 能利用葡萄糖产酸产气, 可利用果糖、半乳糖和蜜二糖产酸, 可初步认为是异型的短乳杆菌(Lactobacillus brevis); LB-3和LB-10能利用葡萄糖产酸但不产气, 而且能发酵七叶苷、果糖、半乳糖、乳糖、甘露糖、蜜二糖、甘露醇、纤维二糖、木糖、海藻糖和山梨醇, 与于佳弘等[12]对玉米(Zea mays)青贮的研究结果基本一致, 可初步认定为类干酪乳杆菌(Lactobacillus paracasei)。
| 表1 乳酸菌属水平的鉴定结果 Table 1 Identification of lactic acid bacteria at the genus level |
| 表2 糖发酵试验结果 Table 2 Results of sugar fermentation test |
为进一步准确判定乳酸菌种属情况, 进行了16S rRNA分子生物学鉴定试验, 将测序结果与Microbes Nucleotide数据库中已知的菌种序列进行比对分析, 找出与目的序列同源性最高的菌种。LB-1与植物乳杆菌(Lactobacillus plantarum)同源性最高(表3); LB-5、LB-6、LB-12与短乳杆菌(Lactobacillus brevis)同源性最高; 菌株LB-2、LB-4、LB-7、LB-8、LB-9、LB-11与戊糖片球菌(Pediococcus pentosaceus)同源性最高; 菌株LB-3、LB-10与类干酪乳杆菌(Lactobacillus paracasei)同源性最高。
| 表3 16S rRNA同源性比对结果 Table 3 Results of 16S rRNA homology comparison |
构建12株乳酸菌的系统发育树, 如图1所示。12株乳酸菌分别属于乳杆菌属和片球菌属, 其中菌株LB-1与植物乳杆菌(Lactobacillus plantarum)相似性达99%; 菌株LB-5、LB-6、LB-12与Lactobacillus brevis的亲缘关系比其它菌株近, 可鉴定为短乳杆菌; 菌株LB-2、LB-4、LB-7、LB-8、LB-9、LB-11与Pediococcus pentosaceus以98%的相似度在同一聚类上, 可鉴定它们为戊糖片球菌; 菌株LB-3与Lactobacillus paracasei以99%的相似度聚在一支上, 结合16S rRNA同源性比对结果, 确定LB-3和LB-10为类干酪乳杆菌。
LB-3、LB-4、LB-7、LB-8、LB-9、LB-10和LB-11具有相似生长趋势, 3~9 h处于对数生长期, 12 h进入稳定生长期, 48 h时未观察到衰退现象[13] (图2)。LB-2和LB-6生长速率较慢, 6 h后开始进入对数生长期, 二者分别于9和12 h趋于稳定。LB-5和LB-12在0 h时即迅速繁殖, 且分别于9和6 h时进入生长稳定期。LB-1在3~6 h为对数生长期。
12株乳酸菌株培养48 h的产乳酸能力如图3所示。LB-1、LB-3、LB-8和LB-9的乳酸浓度分别为1 730、1 920、2 820和2 340 mg· L-1, 显著高于其它菌株(P< 0.05)。结合图2菌株生长速率, 初步选取LB-1、LB-3、LB-8和LB-9作为高产乳酸的初筛菌用于进一步筛选。
LB-1和LB-3的产酸速率较快, 9 h时pH降至最低值3.8(图4); LB-8和LB-9的产酸速率较慢, 21 h时pH降至最低值3.9, 这与张慧杰等[14]研究发现的乳酸杆菌较乳酸球菌具有更强的产酸能力结果基本一致。
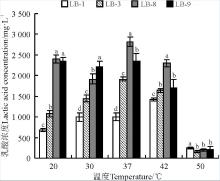
4株初筛菌在不同温度时的生长代谢性能有很大差异。整体上看, 50 ℃时的OD值均明显低于其它温度, 乳酸产量也明显低于其它温度(图5); 可见这4株显著低于LB-3和LB-8(P< 0.05)。说明菌株LB-3和LB-8在pH为4.5~8.5时均能良好生长且有较强的乳酸菌均不适宜在50 ℃时生长, 20~42 ℃的温度范围则有利于菌株繁殖, 但LB-9在42 ℃几乎不生长, 予以筛除。从产乳酸角度看, 20~42 ℃有利于乳酸生成和累积。虽然LB-1繁殖能力强, 但其在不同温度时的产乳酸能力显著低于LB-3和LB-8(P< 0.05), 故LB-1予以筛除(图6)。42 ℃时LB-3和LB-8的乳酸产量较高, 由于乳酸菌的理论适宜温度为37 ℃, 因此初步判定LB-3和LB-8具有一定的耐高温生长特性。
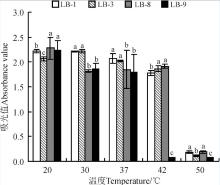 | 图5 4株初筛乳酸菌株在不同温度时的OD值Fig. 5 OD values in preliminary screening of 4 lactic acid bacteria under different temperatures |
4株初筛乳酸菌在较低pH(≤ 3.5)时的OD值很低, 不适合生长繁殖(图7)。pH为4.5~7.5时4株乳酸菌的OD值较高, 适宜生长且能产生一定量乳酸, 但LB-1和LB-9在pH为8.5的弱碱性条件下时OD值耐酸性和偏碱环境适应能力, 尤其LB-8菌株在pH为4.5~8.5时的产酸能力均显著高于其它菌株(P< 0.05)(图8)。
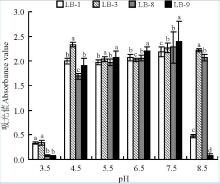 | 图7 4株初筛乳酸菌株在不同初始pH时的OD值Fig. 7 OD values of in preliminary screening of 4 lactic acid bacteria under different initial pH |
青贮饲料中常见的乳酸菌包括乳杆菌属、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)、肠球菌属(Enterococcus)、片球菌属和魏斯氏菌属(Weissella)等[15]。Pang等[16]从玉米秸秆青贮料中分离得到了植物乳杆菌、短乳杆菌、戊糖乳杆菌(Lactobacillus pentosus)、乳酸明串珠菌(Leuconostoc lactis)、魏斯氏乳酸菌(Weissella cibaria)和蒙氏肠球菌(Enterococcus mundtii)。何轶群等[17]从玉米秸秆青贮料中分离鉴定出植物乳杆菌、戊糖片球菌、发酵乳杆菌(Lactobacillus fermentium)、屎肠球菌(Enterococcus faecium)和肠膜明串珠菌肠膜亚种(Leuconostoc mesenteroides subsp.)。王彦苏等[18]从水稻(Oryza sativa)秸秆中分离得到干酪乳杆菌(Lactobacillus casei)和耐乙醇片球菌(P. ethanolidurans)。阿布都克尤木· 麦麦提等[19]从小麦(Triticum aestivum)秸秆中分离得到副干酪乳杆菌亚种(Lactobacillus paracasei subsp.)、鼠李糖乳杆菌(Lactobacillus rhamnosus)、肠球菌(Enterococcus faeciu)。张永辉等[20]从新疆棉花(Gossypium)秸秆中分离出了植物乳杆菌和戊糖片球菌。陶雅等[11]从短芒大麦(Hordeum brevisubulatum)草中分离得到类布氏乳杆菌(Lactobacillus parabuchneri)、戊糖乳杆菌、短乳杆菌和戊糖片球菌。本研究从玉米秸/白菜混贮料中分离得到植物乳杆菌、戊糖片球菌、类干酪乳杆菌(Lactobacillus paracasei)和短乳杆菌, 混贮发酵体系中的乳酸杆菌较乳酸球菌丰富, 这与陶雅等[11]分离得到的乳酸杆菌属较片球菌属多的结果一致, 但与其它文献报道有所差异, 这可能是青贮原料来源、青贮发酵的生化反应过程、环境温度等因素不同所致。
发酵过程的乳酸菌数量及其生长特性是青贮成功与否的关键因素, 而发酵品质的主要限制因素是缺少高活性、产酸能力强的乳酸菌[21, 22]。干秸秆或尾菜等原料自身附着的乳酸菌数量少, 导致青贮发酵过程较慢[1, 10]。通过添加优良的乳酸菌制剂等方法可加快青贮过程中的乳酸发酵进程, 有效改善青贮品质, 因此筛选生长繁殖速度快、产酸能力强的乳酸菌很有必要。
本研究分离得到的植物乳杆菌、戊糖片球菌和类干酪乳杆菌为同型发酵乳酸菌, 短乳杆菌为异型发酵乳酸菌。依据乳酸菌代谢理论, 同型发酵乳酸菌能够利用1分子葡萄糖产生2分子乳酸, 迅速降低环境pH, 是青贮发酵的主导菌群; 而异型发酵乳酸菌利用1分子葡萄糖仅能产生1分子乳酸, 效率仅为同型发酵乳酸菌的17%~50%[23]。本研究初筛得到的LB-1、LB-3、LB-8和LB-9均为同型发酵乳酸菌, 生产繁殖能力和产酸能力强。其中, LB-1生长速率最快, 但产乳酸能力低于LB-3、LB-8和LB-9; LB-3的pH下降最快, 产乳酸能力强, 这与赵婧等[24]研究得出类干酪乳杆菌产酸量高结果一致, 并且LB-3在高温条件下乳酸大量积累; LB-8在不同温度及不同pH条件下乳酸浓度最高, 这与保安安等[25]研究得出戊糖片球菌可迅速降低青贮料pH结果基本一致; LB-9虽产酸能力较强, 但在42 ℃时生长缓慢。
研究表明, 高温(30~40 ℃)青贮容易产生丁酸发酵, 发酵品质较差; 低温(5~15 ℃)青贮则发酵强度较弱, 需要较长时间来抑制肠杆菌、芽孢杆菌和酵母等腐败微生物[6, 7]。Wang和Nishino[26]认为高温青贮时乳酸菌、好氧性细菌和酵母菌的繁殖及乳酸发酵会被抑制, 乙酸发酵增强。因此在夏秋高温季节的玉米秸/尾菜混贮过程中, 添加优良的耐高温乳酸菌株有利于提高混贮成功率, 改善发酵品质。研究中分离得到的菌株LB-3和LB-8在42 ℃高温时具有较强的生长能力和产乳酸能力, 符合McDonald等[27]提出的理想青贮用乳酸菌添加剂标准。建议类干酪乳杆菌LB-3与戊糖片球菌LB-8可以制成复合乳酸菌剂用于夏秋季节高温青贮饲料的调制。复合乳酸菌剂的组成多样性有利于各菌株之间发挥协同作用, 提高青贮品质[28]。但是该复合乳酸菌剂是否能提高青贮品质还有待研究。
从玉米秸/尾菜混贮料中共分离出12株乳酸菌, 通过传统的形态学、生理生化特征分析和16S rRNA 鉴定, LB-1是植物乳杆菌(Lactobacillus plantarum), LB-3和LB-10是类干酪乳杆菌(Lactobacillus paracasei), LB-5、LB-6和LB-12是短乳杆菌(Lactobacillus.brevis), LB-2、LB-4、LB-7、LB-8、LB-9和LB-11是戊糖片球菌(Pediococcus pentosaceus)。其中菌株LB-3和LB-8产酸能力强且都具有优良的耐酸碱、耐高温特性, 可作为良好的乳酸菌青贮菌剂应用于青贮饲料中。
(责任编辑 苟燕妮)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|