第一作者:高晶(1992-),女,甘肃民勤人,在读硕士生,研究方向为生鲜乳的质量控制。E-mail:[email protected]
黄曲霉毒素是严重威胁动物与人类健康的一类真菌毒素。牧草在收割、运输与贮存过程中极易发霉,易被黄曲霉毒素侵染。反刍动物采食感染有黄曲霉毒素的饲料后,其乳汁中也会分泌出黄曲霉毒素,即使微量的黄曲霉毒素也可对动物和人体造成危害。因此,本文对饲料及乳制品中黄曲霉毒素的来源、危害、检测技术以及预防措施进行了综述,并对其检测技术进行重点阐述,以期为在生产实践中能够准确、快速、实时地检测饲料及乳制品中的黄曲霉素提供理论依据与指导。
Aflatoxins are mycotoxins that pose serious threat to animal and human health. Forage is susceptible to mildew during the course of harvest, transportation, and storage, which leads to the production of aflatoxins in feed. Forage is the major feed source for ruminants. When ruminants are fed with aflatoxin-contaminated feed, aflatoxins will be secreted in the milk. Even trace amounts of aflatoxins can be harmful to animals and human beings. Therefore, this paper summarizes the sources, perniciousness, detection techniques and preventive measures of aflatoxins in feed and dairy products, with an emphasis on detection technologies, to provide a theoretical basis and directions for accurate, fast and one-step detection of aflatoxins in production practices.
近年来, 乳制品中霉菌毒素感染的问题逐渐引起大众的关注。2011年, 蒙牛集团被抽查出其牛奶中黄曲霉毒素M1(aflatoxin, AFM1)超标140%, 引发了消费者对乳制品安全问题的质疑。黄曲霉毒素于20世纪60年代初被发现, 其主要是由黄曲霉菌(Aspergillus flavus)、集蜂曲霉菌(Aspergillus fumigatus)以及寄生曲霉菌(Aspergillus niger)等产毒真菌所产生的一大类次生代谢产物[1, 2, 3], 是目前已知的致癌性、致畸形和致突变性最强的一种化学物质。动物或人体摄入含有黄曲霉毒素的物质后, 会出现个体发育迟缓、抵抗力降低甚至死亡现象[4]。
随着现代农业的发展, 在越来越多的国家中, 奶业已经成为现代农业的支柱产业[5]。在影响奶业发展的重要因素中, 牧草饲料占40%, 饲养管理占25%, 气候条件占20%, 而遗传因素为15%[6]。因此, 牧草饲料是奶业的基础, 对奶业发展有着至关重要的影响。优质牧草是反刍动物粗饲料的主要组成部分[7, 8], 当饲草的品质提高时, 反刍动物的采食量和日产奶量才会随之增加[9]。牛羊饲养户和牧场主为了保证家畜在冬春季节的营养需要, 会将夏秋收割的牧草进行贮存, 牧草的贮存是一个重要的生产环节。有时收割后的牧草没有迅速干燥, 或者在晾晒过程中遇到雨雪天气, 就很容易发生霉变, 产生黄曲霉毒素, 从而进入反刍动物与人类的食物链。因此, 有必要在牧草饲料贮存环节中加强管理, 及时对饲料以及乳制品中的黄曲霉毒素含量进行检测, 从而提高饲料和乳制品的品质, 保障动物和人类的健康。目前, 已有学者对食品中黄曲霉毒素的研究进展进行了综述[10, 11], 而对饲料以及乳制品中黄曲霉毒素检测方法的探讨较少。由于大多数情况下饲料是否发生霉变无法通过肉眼分辨, 很难做到及时发现和处理, 因此本文在对饲料及乳制品中黄曲霉毒素的来源、危害、检测技术以及预防措施进行综述的同时, 着重强调黄曲霉毒素检测技术, 以期为在草业和畜牧业的生产实践中准确、快速和实时地检测饲料及乳制品中黄曲霉毒素的含量提供理论依据与指导。
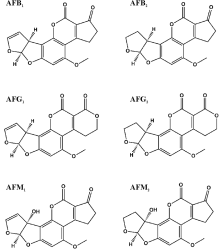
目前已成功分离鉴定出的黄曲霉毒素衍生物大约有20多种, 其中Aflatoxin B1(AFB1)、Aflatoxin B2(AFB2)、Aflatoxin G1(AFG1)和Aflatoxin G2(AFG2)是天然产生的毒性最强, 并且对农作物污染最为严重的4种化合物[12, 13]。当反刍动物摄入了被AFB1和AFB2污染的饲料后, 会在体内代谢产生AFM1和Aflatoxin M2(AFM2)两种化合物, 并且一般会分泌到乳汁中[14, 15]。6种化合物(图1)的毒性大小依次为AFB1> AFM1> AFG1> AFB2> AFG2> AF
随着饲料业的发展, 人们对牧草饲料的品质包括营养价值、适口性和安全性等方面的要求在逐渐提高[23]。牧草饲料在收割、贮运过程中受潮容易霉变, 从而产生黄曲霉毒素。霉变的饲料会产生不良气味, 酸度上升, 营养成分被严重破坏, 会使饲料逐渐甚至完全丧失饲喂价值[24, 25]。Bartov等[26]研究表明, 在贮存过程中, 发生霉变的玉米(Zea mays)中脂肪含量从3.8%降至2.4%; 维生素E含量从22.1%下降到20.6%; 胡萝卜素的含量从3.1 mg· kg-1下降到2.3 mg· kg-1。如果将霉变的饲料用来饲喂动物, 由于饲料已经失去了原有的鲜味甚至带有异味, 会使动物的采食量严重下降[27, 28]; 即使采食, 也会因为营养物质的损失以及产生的黄曲霉毒素影响动物的健康, 导致其产生不适感甚至中毒[29, 30, 31]。AFB1普遍存在于发生霉变的粮食作物中, 根据联合国粮农组织(Food and Agriculture Organization of the United Nations, FAO)的统计, 全世界每年谷物产量的25%都受到了霉菌毒素的污染[32]。因此, 我国卫生部发布并实施了食品安全国家标准GB 13078-2001和GB 2761-2011, 对饲料以及饲料添加剂中的AFB1最高限量标准进行了规定[33, 34](表1)。
| 表1 我国饲料以及饲料添加剂中黄曲霉毒素B1的限量标准 Table 1 Standard limits of AFB1 in feed and feed additives in China |
动物对黄曲霉毒素较为敏感, 通常高剂量的黄曲霉毒素会导致动物急性死亡, 而长时间摄入低剂量的黄曲霉毒素会损坏动物的肝功能、生长性能、生殖系统、免疫机能以及造血功能等。
黄曲霉毒素能对动物肝脏产生很大的毒害作用, 导致白蛋白浓度、血清总蛋白、谷丙转氨酶和谷草转氨酶这4项反映肝脏功能的重要指标活性的升高。Siloto等[35]研究发现, 用添加了1 mg· kg-1黄曲霉毒素的日粮饲喂蛋鸡, 会导致蛋鸡的肝脏发生病变。Fetaih等[36]研究发现, 对小鼠注射1 mg· kg-1的AFB1后可导致雌鼠的肝脏、肾脏等内脏受损。
黄曲霉毒素可以通过降低一些胰腺酶的活性, 抑制淀粉酶、胰蛋白酶和其它激素的合成, 从而损害动物的生长性能。在饲料中添加500 μ g· kg-1的低剂量黄曲霉毒素后, 猪的采食量下降, 日增重减少, 生长缓慢[37]。奶牛采食了含有高剂量AFB1(213.6 μ g· kg-1)的羊草(Leymus chinensis)后死亡, 其胃壁损伤严重, 肠黏膜粘连, 小肠溃烂, 并伴有肝脏肿大出血[38]。
黄曲霉毒素会损害动物的生殖系统, 极易导致雌性动物产生卵巢畸形、萎缩以及子宫肿胀、扩张等症状, 容易引发雌性动物流产或者死胎; 还会引发雄性动物睾丸萎缩、雌性化。给雄性维斯塔鼠注射不同剂量(10、20、50 μ g· kg-1)的AFB1, 会导致其精子数量和生殖器官的相对比重减少, 并且睾丸素以及睾丸类固醇合成酶的水平也会明显降低[39]。
黄曲霉毒素可以在分子水平上与DNA和RNA结合, 干扰基因复制和表达, 影响蛋白质的合成, 延迟淋巴因子的激活, 使淋巴细胞产生减少, 从而抑制机体的免疫机能。Mehrzad等[40]使用0.5 ng· mL-1的AFB1处理牛血液中的中性粒细胞3 h后发现, AFB1降低了中性粒细胞对葡萄球菌与大肠杆菌的吞噬和杀死功能, 因此得出AFB1可以抑制牛的非特异性免疫功能的结论。
黄曲霉毒素会对动物的造血功能造成影响。黄曲霉毒素可以使血液中的血浆蛋白量、血红蛋白(HGB)、红细胞压积(HCT)明显降低, 易破坏部分血凝素。李瑞娟等[41]用含有不同浓度AFB1(0、2.8、4.2、5.6 mg· kg-1)的饲料连续饲喂雏鸡14 d, 结果表明, 血液中的白细胞总数(WBC)、红细胞(RBC)、红细胞积压(HCT)、血小板(PLT)、血红蛋白(HGB)含量均呈降低趋势, 在AFB1浓度为2.8 mg· kg-1时的血液生理指数显著降低, 开始出现贫血症状。
当AFM1随乳制品进入人体时, 会对人体的血液、肌肉和内脏器官产生不同程度的伤害, 其中对肾脏和肝脏的损伤最大。黄曲霉毒素在反刍动物体内的代谢非常迅速, 反刍动物采食了被AFB1污染的饲草, 12 h后可在乳汁中检测到AFM1, 并在24 h达到最高浓度[42]。动物在停止采食含有AFB1的饲草4 d后, 其乳汁中的黄曲霉毒素才会消失[43]。泌乳母羊对饲料中AFB1的摄入量与所产乳汁中AFM1含量的转化率介于0.1%~6%[44]。
乳制品受到AFM1污染是全世界范围的问题。如Rama等[45]对科索沃的原料奶和UHT(超高温瞬时灭菌)奶共895个样本中的AFM1检测后发现, 有2.8%的原料奶和2.6%的UHT奶样品中检测到AFM1, 其污染含量在5~50 ng· L-1。又如Chavarrí a等[46]对哥斯达黎加上市乳制品中共210个样本中的AFM1进行了调查, 结果表明, 在检出含有黄曲霉毒素的30个牛奶样品和10个奶酪样品中, AFM1浓度分别为19~629和31~276 ng· L-1, 平均值分别为136和74 ng· L-1, 超过了欧盟限量标准。再如Han等[47]对我国十大牛奶生产地区的牛奶共计200个样本进行了检测, AFM1的检出率为23.5%(表2)。鉴于乳制品受到AFM1污染的普遍性, 大多数国家都立法规定了乳制品中AFM1的最高限量标准(表3)。
| 表2 中国十大产奶地区原料奶中AFM1的含量 Table 2 Concentrations of AFM1 in the raw milk samples from ten areas in China |
| 表3 世界部分国家和组织对奶及奶产品中AFM1的限量标准 Table 3 Standard limits of AFM1 in milk in some countries and organizations |
目前, 黄曲霉毒素的检测方法主要有薄层分析法(thin layer chromatography, TLC)、高效液相色谱法(high performance liquid chromatography, HPLC)、免疫分析法、生物传感器法以及毛细管电泳法(capillary electrophoresis, CE), 这些方法都有着各自的优缺点。
薄层分析法是测定食品和饲料中黄曲霉毒素含量的传统检测方法, 并且应用非常广泛。薄层分析法的原理是, 用合适的萃取溶剂将黄曲霉毒素从样品中萃取出来, 经过柱层析净化后, 将收集的黄曲霉毒素在薄层板上进行层析, 根据黄曲霉毒素形成荧光斑的强弱程度与标准进行对比, 从而确定样品中黄曲霉毒素的含量。薄层分析法分为单项展开法和双向展开法, 双向展开法的操作步骤繁多, 用时长, 但是可以很好地去除杂质, 通常对于比较复杂的样品, 需要使用双向展开法才能获得较好的灵敏度[48]。
高效液相色谱法是近年来发展最快的一种黄曲霉毒素检测技术。其检测原理是以液体为流动相, 将样品带入到装有固定相的色谱柱上, 通过调节流动相中溶剂的比例和极性, 影响样品中各化合物在流动相与固定相之间的分配, 使得黄曲霉毒素与其它化合物分离后到达检测器, 从而实现对样品定性和定量的分析。高效液相色谱法检测精确度高, 灵敏度和重现性较好。例如Bellio等[49]用高效液相色谱法对意大利北部采集的奶样进行AFM1检测, 方法的线性范围为0.75~25 μ g· mL-1, 平均回收率为93%~96%。屈俊成等[50]用高效液相色谱法对0~60 ng· mL-1的AFB1标准品进行测定, 相关系数达到了0.999 9, 平均回收率为85%~90%; 对饲料中的AFB1进行检测, 相对偏差为4.22%。高效液相色谱法一般使用免疫亲和柱来对样品中的黄曲霉毒素进行进样前的分离纯化, 并且有很好的纯化效果[48], 因此, 该法的使用范围最广。但是, 高效液相色谱法的局限性在于前处理方法繁琐, 对操作人员技术要求高, 检测周期长, 以及仪器设备昂贵等。
免疫分析法的原理是通过抗原和抗体的特异性结合反应来检测提取目标化合物。其检测成本低, 操作简单, 重现性好, 并且其灵敏度和特异性比薄层色谱法好。免疫分析法一般包括3种:金标免疫层析法(gold labeled immuno-chromatographic assay, GICA)、免疫亲和柱(immuno affinity chromatography, IAC)荧光光度法和酶联免疫法(enzyme-linked immunosorbent assay, ELISA)。金标免疫层析法是一种固相免疫法, 利用抗体和抗原的特异性结合, 一步完成对黄曲霉毒素的检测。赵晓联等[51]用金标免疫层析法对粮油食品中的AFB1进行检测, 最低检测限为2.5 ng· mL-1, 灵敏度较高, 可以在5~15 min内完成对所测样品中黄曲霉毒素的定性检测。金标试纸法操作简单迅速, 试纸在4 ℃的环境下可以稳定10个月以上, 不需要借助任何实验设备仪器, 对场地也没有特殊要求, 在农田、仓库等地方均可以进行方便快速的检测[52], 但是其检测的精确度和准确性仍然有待提高。
在免疫亲和柱-荧光光度法中, 免疫亲和柱的固相是以共价键结合了抗体的惰性微珠。当抗原溶液通过免疫亲和柱时, 柱上的抗体会对黄曲霉毒素抗原产生特异性吸附, 而其它化合物则沿柱流下, 最后用合适的洗脱液洗脱抗原, 从而将目标化合物纯化, 之后借助紫外灯和荧光计, 对洗脱的物质进行检测。王伟等[53]使用免疫亲和柱-荧光光度法对牛奶中的AFM1进行检测, 其检测限为0.1 μ g· kg-1, 检测的相对标准偏差小于5%, 回收率为88%~93%。该方法的优点是检测速度快, 处理一个样品的时间为10~15 min, 适用于大量样品的处理, 且定量准确, 此外操作人员无需使用有毒有害溶剂, 既保证操作人员的安全性, 也减少了对坏境的污染, 但是该方法需要配备专门的仪器设备, 检测费用高。
酶联免疫法是近几年研究出的较为新颖的检测方法。酶联免疫法测定的对象可以是抗体也可以是抗原, 其原理是采用抗原与抗体的特异性反应将待测物与酶连接起来, 通过酶与底物的显色反应, 结合酶标仪, 根据颜色的深浅进行定性或者定量的分析[48]。如Omar[54]使用酶联免疫法对约旦鲜奶样品中的AFM1进行检测, 通过在鲜奶中加入不同浓度(20、100、300 ng· L-1)的AFM1标准品, 得到的回收率分别为102.1%、94%和99%, 并且重复性较好。酶联免疫法可高效、快速地检测样品中黄曲霉毒素的含量, 在饲料的测定方法中被国标所推荐, 对人体的危害小, 但是其也有一定的缺陷性, 如需要配备专门的仪器, 试剂盒中的试剂寿命短、需低温保存, 检测结果重复性差, 假阳性概率高, 以及操作复杂等。
生物传感器是由固定化的生物敏感材料作识别元件、理化换能器以及信号放大装置构成的分析工具或系统[55], 是可以探测生物体内外的环境化学物质或者与其特异性交互作用后产生响应的一种装置。生物传感器法包括酶传感器法和免疫传感器法。
酶传感器法的原理是将黄曲霉毒素氧化酶固定在开管的多壁纳米碳管上, 将其用作电极测定AF
免疫传感器法的原理是利用抗原(抗体)对抗体(抗原)的识别功能而研制成的生物传感器。Parker和Tothill[58]制备了一种电化学免疫传感器, 对牛奶中AFM1的检测限为39 ng· L-1, 最大响应值达到1 000 ng· L-1。Daly等[59]研制了一种表面等离子共振型光学免疫传感器, 利用间接竞争检测法测定AFB1, 该免疫传感器的线性工作范围为15~100 ng· L-1, 检测限为15 ng· L-1。在这种免疫传感器的制作过程中, 生物分子的定向固定量、活性保留程度等都会影响传感器的性能, 因此还有待进一步的研究才能将其用于实践。总而言之, 生物传感器具有操作简单、响应快、选择性高并且方便携带的特点, 但是目前该技术尚不够成熟, 无法同时满足对灵敏度和稳定性的要求, 还需进一步改善。
毛细管电泳法是一类以毛细管为分离通道、以高压直流电场为驱动力的新型液相分离技术, 它是依据样品中各组分之间的迁移速度和分配行为上的差异而实现对目标化合物的分离检测方法。当毛细管电泳法与激光诱导荧光检测器连用时, 可以很好地提高灵敏度。Arroyomanzanares等[60]用毛细管电泳-激光诱导荧光检测法检测AFB1、AFB2、AFG1和AFG2的混合物时, 取得了理想的分离效果, 并且该法对AFB2的检测最为灵敏。由于毛细管电泳法的操作复杂, 成本也较高, 因此目前尚不适于在样品检测中广泛应用。
程传民等[61]对全国27个省的2 423个饲料原料样品中的黄曲霉毒素进行调查后发现, 我国饲料原料中受到黄曲霉毒素污染面很广, 检出率较高(表4)。其中, 以华中地区受到的污染最为严重, 并且不同品种的饲料产品所受到的污染程度也存在较大的差异, 其中玉米副产物中的检出率最高, 玉米中的超标率最高且最大值达到了232.4 μ g· kg-1, 远远超出了我国对饲料中黄曲霉毒素的法定标准(表1)。因此, 预防黄曲霉毒素在饲料原料中的发生非常重要, 其中防霉是关键。防霉的主要措施包括严格控制原料及产品的贮存条件、贮存前做杀菌处理以及培育抗产毒和抗侵染的品种3个方面。
| 表4 我国不同生产地区以及不同饲料原料中AFB1的检测结果 Table 4 The results of AFB1 detection in different production areas and different feeds in China |
首先, 牧草等饲料收割贮存时要严格控制贮存条件, 包括控制原料及产品的水分、低温贮存、无氧保存以及保持设备清洁。饲料在收获后要迅速进行干燥, 当饲料中的水分低于15%时, 霉菌不易繁殖[62, 63, 64] ; 饲料最理想的贮存温度是12 ℃以下[65], 在这个温度下害虫的活动以及繁殖都会停止[66], 当水分含量保持在15.5%~17.5%, 冷却至10 ℃后, 安全贮存期可以达到6~10个月[67]; 大多数霉菌在无氧条件下不能生长繁殖[68], 将饲料贮存在充有CO2的密闭空间内, 对其进行包装, 可很大程度保证饲料不发生霉变, 还可以防止虫害; 要保证贮存设备的清洁度, 霉菌在自然界中的分布非常广泛, 粉尘和空气中都含有霉菌孢子, 因此, 饲料很容易被自然界中的霉菌孢子污染[69], 务必要保持饲料收获到贮存各个环节设备以及场地的卫生清洁。
其次, 牧草等饲料收割贮存前做杀菌处理, 包括使用防霉剂和辐射防霉。适时的应用防霉剂, 可以延长饲料等贮存品的保质期, 常用的防霉剂主要包括山梨醇及其盐类, 丙酸及其盐类, 双乙酸钠, 延胡索酸等[70]; 在减少真菌导致食物引起的疾病方面辐射可以发挥重要作用[71], 美国农业部原子能研究所使用1× 106 Radγ -射线对饲料和粮食进行辐射后发现, 相对湿度80%以上、30 ℃的环境下, 也可以存放45 d以上[72]。
最后, 农作物抗霉的能力与其遗传因素有很大关系, 培育抗产毒和抗侵染的品种, 农作物便可以利用其自身的抗性来抵抗黄曲霉的污染[73]。Bryden[73]研究表明, 可以通过培育抗真菌的农作物来抵抗黄曲霉的污染, 从而降低饲料中黄曲霉毒素的含量。
随着消费者对食品安全意识的日益增加, 乳制品的安全问题也越来越受到关注。奶牛被饲喂感染有黄曲霉毒素的饲料后, 所产的奶中也含有黄曲霉毒素, 而即使微量的黄曲霉毒素对动物与人体也会造成巨大的危害。在此, 本文对饲料以及乳制品中的黄曲霉毒素从来源、危害、检测技术和预防措施等方面进行了综述, 尤其对当前的各种检测技术进行了重点分析。在各种检测方法中, 薄层分析法的样品前处理复杂, 特异性较差, 灵敏度也不高, 回收率低, 容易造成样品污染; 使用免疫亲和柱的方法, 虽然特异性较好, 但是检测成本和技术要求很高; 高效液相色谱法所需仪器设备昂贵, 投资较大, 检测成本也比较高, 对操作人员的技术要求高; 酶联免疫法的方法相对来说, 操作方便, 污染程度小, 灵敏度高, 特异性好, 成本也较低; 生物传感器的方法操作简单、响应快、选择性高并且方便携带。但是该方法技术不够成熟, 无法同时满足对灵敏度和稳定性的要求; 毛细管电泳检测对黄曲霉毒素的分离效果明显, 灵敏度也很高, 不需要使用有毒试剂, 但是毛细管电泳法的操作复杂, 成本也很高, 不适于在样品检测中广泛应用。因此, 如果在现有各种方法的基础上, 简化操作步骤, 降低成本, 不但可以满足分析测试的基本要求, 还可以促进草业、畜牧业和奶业的发展, 从而带来巨大的生态、社会和经济效益。
(责任编辑 武艳培)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|