第一作者:李莎莎(1988-),女,山东单县人,研究实习员,硕士,主要从事牧草育种与栽培研究。E-mail:[email protected]
苜蓿( Medicago sativa)是我国乃至全世界最优质的豆科牧草之一,具有较高的经济价值、营养价值和生态价值。然而我国的苜蓿种植大多集中在干旱半干旱的西北、东北一带,水分是影响其产量的主要因素。本文通过对比光合呼吸系统、活性氧防御系统、渗透调节系统、脱落酸等在干旱胁迫下的变化分析了苜蓿抵御干旱胁迫的生理机制,同时对转录因子、蛋白酶基因和抗旱基因在苜蓿干旱胁迫下的应答过程进行了阐述,并对未来苜蓿应答干旱胁迫的研究重点进行了展望。
Alfalfa ( Medicago sativa) is a major forage crops throughout the world, and of great nutritional, economic, and ecological value. It is mainly cultivated in the northwestern and northeastern regions of China, where water is the main limiting factor influencing plant yield. In this study, we quantified changes in photosynthesis, respiration, antioxidant activity, osmoregulation, and abscisic acid levels under drought stress, and proposed the mechanisms of physiological response to drought stress in alfalfa. The response process involving transcription factors, protease genes, and drought-resistance genes under drought stress was investigated as well. In conclusion, our study emphasized the importance of response to drought stress in alfalfa from a new perspective.
苜蓿(Medicago sativa)具有较高的产量和较好的营养价值、适口性好等优点, 除此之外, 苜蓿在农业生态系统氮循环、植被恢复、水土保持、培肥地力、改良土壤等方面也具有重要的作用, 有“ 牧草之王” 、“ 草黄金” 的美誉[1, 2, 3]。作为优质的蛋白饲草, 苜蓿被各国广泛种植, 苜蓿在美国的地位等同于粮食作物, 种植面积仅次于玉米(Zea mays)、小麦(Triticum aestivum)和大豆(Glycine max)[4]。苜蓿在我国的种植历史悠久, 据史料记载, 我国的苜蓿种植始于汉代, 引自西域, 迄今已经有两千多年的历史[5]。
数据显示, 全球超过1/3的土地处于干旱和半干旱状态, 我国有近一半的耕地处于干旱和半干旱状态, 干旱成为制约部分地区农业、经济、社会和生态发展的主要因素, 干旱造成的影响最广, 造成的经济损失最大, 被认为是世界上最严重的自然灾害类型之一, 也是制约我国农业发展的主要非生物胁迫之一[6, 7, 8]。依据《中国多年生栽培草种区划》所划分, 我国苜蓿六大种植区大多集中在我国西北和东北干旱、半干旱区域, 干旱是影响其产量的主要因素[9]。现阶段, 国内的苜蓿良种短缺、缺乏优质苜蓿产品, 难以满足国内生产需求, 对国外进口苜蓿的依存度较高, 极大地制约了我国苜蓿产业的发展[10, 11]。国内育成的苜蓿品种主要以抗寒、抗病虫、耐盐碱、耐牧以及优质高产为主, 缺少抗旱品种[11]。紫花苜蓿抗旱的生理指标研究已经非常深入, 随着生物技术研究的不断发展, 国内外学者对紫花苜蓿抗旱的研究已由生理机制转向分子机理方面[12, 13]。为此, 本文通过对比光合呼吸系统、活性氧防御系统、渗透调节系统、脱落酸等在干旱胁迫下的变化分析苜蓿抵御干旱胁迫的生理机制, 同时对转录因子、蛋白酶基因和抗旱基因在苜蓿干旱胁迫下的应答过程进行阐述, 并对未来苜蓿应答干旱胁迫的研究重点进行展望, 以期为苜蓿的抗旱研究提供理论基础。
可利用的水资源对植物生长和光合作用的影响早期已有广泛的研究[14, 15, 16]。干旱会引发植物水分亏缺, 从而影响植物的正常生长, 促进细胞衰老, 严重时甚至会导致植物死亡; 干旱还通过一系列的途径抑制光合作用, 如抑制叶片的伸展、降低叶绿体的活性等, 从而影响植物的生长发育[17, 18]。作为光合作用的必要条件之一, 叶绿素也可作为抗旱指标, 干旱通过影响叶绿素的生物合成过程以及促进合成的叶绿素加速分解等过程, 导致植物叶片叶绿素含量降低[19]。有研究发现, 干旱胁迫在一定程度上降低了叶绿素a、叶绿素b的含量以及叶绿素总量, 减慢了光化学效率, 同时显著增加了叶片丙二醛和脯氨酸含量[17]。韩瑞宏等[20]对两种抗旱性不同的紫花苜蓿进行干旱胁迫下光合生理研究发现, 干旱胁迫会造成两种紫花苜蓿的净光合速率、蒸腾速率、气孔导度、叶绿素含量不同程度的下降, 并且叶绿体的超微结构已经遭到破坏。同时该研究发现, 干旱胁迫还使光系统Ⅱ (PSⅡ )受到伤害, PSⅡ 原初光能转化效率降低, PSⅡ 潜在活性中心受损, 光合作用原初反应过程受到抑制。对干旱胁迫下不同羊草(Leymus chinensis)的反应研究时发现, 干旱胁迫下, 不同品种羊草的光合速率均有降低的趋势, 且不同品种的羊草的净光合速率变化差异显著[21]。
活性氧在植物应对非生物胁迫中扮演了一个重要的角色, 它既是胁迫下新陈代谢的有毒副产物, 同时也是一种重要的信号转导分子[22]。植物通过不同细胞间多重通路微妙的调节来适应环境, 一旦细胞或者植株暴露在水分或盐胁迫等水势急速下降的环境中, 这种通路就会被打开, 高能电子被转移到分子氧上, 形成活性氧, 譬如, H2O2、· O2-、1O2、· OH、HO2· , 过量的活性氧分子会对植物的蛋白质、DNA以及脂类物质等造成氧化损伤[23, 24, 25, 26]。几乎在所有的胁迫环境下, 活性氧的积累和相关的氧化损伤都极大程度的被激活, 导致细胞膜的不稳定和严重的细胞伤害, 甚至会导致细胞的死亡[25, 27]。植物在正常的新陈代谢过程特别是胁迫环境中必不可少的是活性氧的解除, 植物抗氧化系统由抗氧化剂类和抗氧化酶类两部分组成[28]。抗氧化剂主要有抗坏血酸(AsA)、谷胱甘肽(GSH)、甘露醇、α -生育酚等, 活性氧清除酶类主要有超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)、过氧化物氧化还原酶(PRDX)[24, 26, 28, 29, 30]。植物体内的抗氧化剂以及活性氧清除酶将植物体内产生的多余活性氧分子通过一系列生理生化反应转化成H2O和O2(图1)。研究表明, 抗旱性强的苜蓿品种, 在干旱条件下的草产量较高, 并且其叶片的CAT、POD及SOD的活性存有率也高[31]。在对根茎型、直根型和根蘖型苜蓿苗期受干旱胁迫的生理耐受分析试验中发现, 不同根型苜蓿的SOD活性都随着干旱程度的增加而升高[32]。在对干旱条件下接种根瘤菌与不接种根瘤菌的苜蓿抗旱生理指标进行测定时发现, 接种根瘤菌与否, 紫花苜蓿根、茎、叶中GSH含量及SOD和POD活性都随着干旱时间的延长而不断升高[33]。利用不同浓度的PEG-6000溶液对12种抗旱性不同的苜蓿品种进行渗透胁迫处理, 结果显示, 12个苜蓿品种的幼苗在一定的PEG浓度下其POD、CAT和SOD活性均呈现增加的趋势[34]。
 | 图1 植物活性氧清除过程 根据文献[25]整理绘制而成。Fig. 1 Pathways of scavenging of reactive oxygen species in plants Modified by[25]. |
渗透调节是植物在干旱条件下维持植物有效生长膨压的基本生理机制。最近, 研究人员指出渗透调节最主要的避免脱水的机制是积累溶质和细胞壁硬化[35]。这种可溶性物质的积累既不会破坏细胞代谢过程的平衡, 而且在细胞质浓度高的情况下也是无毒的, 以此来降低细胞的渗透势, 从而使得植物在较低水势的生长介质中也能吸收水分(图2)。植物体内积累的渗透调节物质主要包括无机离子、多元醇和可溶性糖类、可溶性蛋白、植物激素、氨基酸及其衍生物和甲胺类化合物[36, 37]。研究中多以脯氨酸、甜菜碱、可溶性糖、可溶性蛋白等有机渗透调节物质作为抗逆生理指标。
脯氨酸在渗透调节中起着至关重要的作用, 它不仅是重要的渗透保护剂, 也可以作为分子伴侣、抗氧化剂、氧化还原平衡的调节器以及碳和氮的来源[38]。可溶性糖主要包括蔗糖、葡萄糖、果糖、半乳糖、果聚糖等, 不同的植物在干旱胁迫下积累的糖分也会有差异。可溶性蛋白主要有胚胎发育晚期丰富蛋白(LEA蛋白)、脱水素、水孔蛋白等[37]。干旱胁迫下, 脯氨酸的积累已经在很多物种上被反复报道过[39]。Hatzig等[40]研究分析, 油菜(Brassica campestris)在体外渗透压力下, 主动积累渗透活性物质, 如脯氨酸及可溶性碳水化合物等, 这表明降低渗透势是其应答干旱胁迫的一个主要的因素。对耐旱的苜蓿品种陇东、中等耐旱的公农1号以及不耐旱的BL-02-329进行干旱胁迫研究, 结果显示, 3种紫花苜蓿的脯氨酸以及可溶性糖含量在一定时间内随胁迫时间的延长呈上升的趋势且总量也逐渐增加[41]。接种根瘤菌与不接种根瘤菌的紫花苜蓿茎、叶中的脯氨酸含量和可溶性糖含量均随干旱时间的延长而增加[33]。利用SDS-PAGE电泳分析法对8个抗旱性强和7个抗旱性弱的苜蓿品种进行干旱胁迫下可溶性蛋白变化分析结果显示, 某些可溶性蛋白随着干旱时间的延长呈现先增加后减弱的趋势; 抗旱性较弱的品种产生的干旱诱导蛋白比抗旱性较强的品种少; 干旱15 h时, 抗旱性强的品种均被诱导产生新的蛋白而抗旱性弱的品种只有两个品种出现新的蛋白, 由此可见, 可溶性蛋白的变化与干旱强度有直接的关系[42]。甜菜碱含量和甜菜碱醛脱氢酶活性在干旱胁迫下明显增加, 且不同的苜蓿品种间差异显著[43]。
脱落酸是植物在应答生物和非生物胁迫过程中调节生理和发育过程的重要的植物激素[44, 45, 46, 47]。由一对保卫细胞组成的气孔不仅控制着与蒸腾作用相关的水分流失, 同时还调节空气与植物体内的O2和CO2的交换。保卫细胞通过渗透作用控制气孔的开闭。植物通过一系列复杂的信号网络实现ABA调节气孔关闭应答干旱胁迫, 水分亏缺的状态下, ABA促进气孔的关闭, 同时抑制气孔的打开以此来减少水分的流失[48]。ABA在土壤水分亏缺的状态下还能够降低叶片的扩张率, 同时通过降低膨压、细胞分裂速率和细胞壁的扩展性来降低空气湿度[49, 50, 51]。干旱胁迫开始后, 紫花苜蓿根部ABA含量随干旱胁迫时间的延长呈上升的趋势, 干旱6 h达到最高, 而叶片中的ABA含量在干旱3 h后也高于未胁迫的对照组[52]。对两种不同抗旱性的苜蓿品种进行干旱处理, 研究结果显示, 不同抗旱性的两种苜蓿品种的ABA含量均随干旱时间的延长而升高[41]。
植物依赖抗旱相关基因的调控抵御各种生物胁迫以及非生物胁迫, 近年来, 部分苜蓿抗旱相关转录因子基因、酶基因等相继被找到(表1)。
| 表1 近年来紫花苜蓿抗旱相关基因研究进展 Table 1 Investigation of drought resistance-related genes in alfalfa in recent years |
干旱应答结合元件(DREB)是一种与非生物胁迫相关的转录因子, 对植物抗逆性起着非常重要的作用, 目前已成功克隆了可能与蛋白抗逆功能相关的紫花苜蓿DREB1基因, 并对其编码的蛋白的理化性质、二级以及三级结构进行了分析[53]。陈李淼等[64]成功克隆了一个大豆脱水胁迫响应相关的bHLH类转录因子GmbHLH25, 该转录因子与苜蓿同源蛋白关系最近, 并将GmbHLH25基因转入到烟草(Nicotiana tabacum)中, 在干旱、高盐胁迫下超表达能够提高烟草的耐旱、抗盐的能力。NAC(NAM、ATAF1/2、CUC2)是最大的植物特定转录因子家族之一, 在植物生长发育和响应环境胁迫方面起重要作用。以SSH-cDNA文库中紫花苜蓿的一个503 bp的EST片段为基础, 克隆了一个新的NAC基因, 它全长1 115 bp, 包括一个816 bp的ORF, 能够编码271个氨基酸, 在不同的干旱胁迫时间进行实时相对定量分析(RT-PCR), 结果显示, 该基因可以被干旱、高盐以及ABA诱导转录表达, 并且转入该基因的拟南芥(Arabidopsis thaliana)比野生型具有更强的抗旱性[54]。在野生大豆(Glycine soja)中发现了一种能够编码WRKY类转录因子的基因GsWRKY25, 将该基因转入到拟南芥中超表达, 结果显示, 能够增加拟南芥的抗旱性, 随后将该基因成功转入到紫花苜蓿中超表达, 将转基因苜蓿种植到盐碱地以及水分亏缺的条件下, 野生型苜蓿表现出叶片萎黄病、生长迟缓甚至死亡, 转基因苜蓿则表现出较低的相对膜透性和丙二醛含量、较多的脯氨酸和可溶性糖积累, 此外, 转基因苜蓿还具有较厚的角质层, 能够减少水分亏缺时植物水分散失[55]。
过氧化物酶是植物参与逆境胁迫重要的保护酶之一。张怡等[56]从紫花苜蓿中克隆出了过氧化物酶基因MsPOD, 并将其转入拟南芥中, RT-PCR和GUS染色显示其在拟南芥中成功表达。将从朝鲜碱茅(Puccinellia chinampoensis)中克隆的控制植物脯氨酸合成的关键酶和限速酶基因PuP5CS通过农杆菌介导转入紫花苜蓿, 对转化植株进行PCR和RT-PCR检测发现, 该基因在RNA水平上正常表达[57]。玉米黄质环氧酶(ZEP)因其在脱落酸生物合成和叶黄素循环中的作用, 在植物非生物胁迫中扮演者重要的角色。Zhang等[58]克隆了一个全长1 992 bp, 能够编码663个氨基酸的苜蓿ZEP基因, 命名为MsZEP, 通过氨基酸序列对比发现其与其他植物高度同源, 通过在烟草中进行超表达发现, 该基因在茎叶中的表达量要显著大于在根中的表达量, 干旱以及盐胁迫下, 该基因通过影响各种生理途径、脱落酸水平以及胁迫应答基因的表达来抵御胁迫。紫花苜蓿中存在一种促分裂原活化蛋白激酶(MAP激酶)MMK4(Medicago MAP Kinase 4), 干旱胁迫可诱导MMK4基因转录水平的增加, 表明其活性是翻译后水平调控[59]。二磷酸核苷激酶(NDPKs)是一类蛋白激酶家族, 它的主要功能是维持除了三磷酸腺苷以外的其他核苷三磷酸分子内水平的生物合成, 植物NDPKs的异位表达显示其是一种能够参与许多重要的细胞过程的多功能蛋白质, 如, 植物生长与发育的监管、响应光敏色素A的信号转导、紫外线B辐射、热应激、H2O2调节的氧化胁迫等。此外, 它在抵抗非生物胁迫过程中起着重要的作用。在拟南芥的NDPKs的3个亚型中, NDPK2与抵御非生物胁迫息息相关。拟南芥的NDPK2是光敏色素调节光信号通路的一个积极的信号组件, 还参与植物H2O2调节的促分裂原活化蛋白激酶信号传导。紫花苜蓿超表达拟南芥二磷酸核苷激酶2(AtNDPK2)基因植株在盐胁迫和水分胁迫下比非转基因植株表现出较高的耐受能力, 此外转基因植株通过增强表达生长激素相关的吲哚乙酸基因(MsIAA3、MsIAA5、MsIAA6、MsIAA7、MsIAA16), 比非转基因植株具有的更好的生长性[60]。
包爱科和王锁民[61]将拟南芥液泡膜H+-PPase基因AVP1通过农杆菌介导转化法导入新疆大叶苜蓿中表达, 同时对表达水平最高和最低的两个转基因系列进行抗逆性检测, 结果显示转基因苜蓿的耐盐性和抗旱性比野生型显著增强。李燕等[62]将目标基因MsZIP成功转入到紫花苜蓿中进行超表达, 然后用25 μ mol· L-1PEG-6000处理转基因苜蓿并测定生理指标, 结果显示, 转基因组与未转基因对照组可溶性糖、可溶性蛋白、脯氨酸含量均增加, 但转基因组紫花苜蓿增幅较大, 两组的丙二醛含量显著增加, 但转基因组增幅比未转基因的要小, 说明MsZIP基因在紫花苜蓿中的超表达能提高苜蓿的耐旱性。水通道蛋白调节水分和其他小分子通过液泡和细胞质膜, 是高度多样化的蛋白家族, 他们与植物的生物和非生物胁迫都息息相关[65]。SNAREs蛋白是一类对植物体内物质运输起着重要作用的蛋白质家族。从紫花苜蓿中克隆了cDNA全长1 396 bp, 能够编码418个氨基酸的MsSNARE基因, qRT-PCR分析发现, 该基因在苜蓿根茎叶内均有表达, 且该基因在干旱胁迫时表达水平上调[63]。
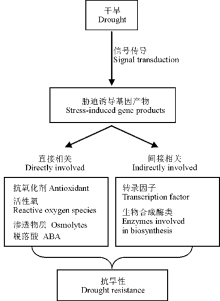
随着我国草畜一体化进程的发展, 国内对优质牧草, 尤其是苜蓿的需求量越来越大。然而苜蓿在我国的种植环境仍未得到较大的改善, 干旱仍是限制其产量和品质的主要因素之一。越来越多的研究者将目光转向了苜蓿抗旱研究, 大量研究发现, 苜蓿抗旱是由一系列的生理生化反应以及与干旱胁迫相关的基因诱导表达调控的结果(图3)。干旱条件下, 紫花苜蓿光合呼吸受到较大的影响, 净光合速率、蒸腾速率、气孔导度、叶绿素含量以及光合系统都不同程度的受到影响, 直接影响其生长。水分亏缺的时候, 苜蓿体内的活性氧含量升高, 造成氧化损伤, 同时苜蓿体内的活性氧防御系统会启动, 抗氧化剂含量升高, 在一定程度上降低氧化损伤。同时, 苜蓿体内的渗透调节物质以及植物激素水平升高, 使其尽可能多的从外界环境中吸收水分, 同时减少植物体内水分的流失。而这一切生理水平的变化都是由基因控制的, 部分抗旱应答元件、转录因子以及抗旱基因相继被找到, 部分基因超表达显示可以改善苜蓿的抗旱性。但是苜蓿的抗旱并不是由单一的基因控制, 多基因如何协同抗旱, 这些目前仍不明确。干旱胁迫后苜蓿抗旱基因如何启动、信号如何传导, 目前的研究中鲜有报道。苜蓿复杂的抗旱机制还有很多的未知需要不断探索, 更多的功能性蛋白以及抗旱应答元件仍需不断研究和发现。随着我国基因工程技术的迅猛发展, 抗逆基因与生物工程技术的结合, 将为苜蓿的抗旱育种工作提供更多的可能。
(责任编辑 王芳)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|