第一作者:梅兰(1993-),女,安徽桐城人,在读硕士生,主要从事生态学相关研究。E-mail:[email protected]
以芦竹属( Arundo)菌草绿洲3号诱导的愈伤组织为材料,进行不定芽、不定根诱导以及移栽试验。以愈伤组织为受体材料,对绿洲3号的遗传转化体系进行初步研究。结果表明,不定芽最佳分化培养基为MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA,不定芽诱导率为100%。不定根诱导的最适培养基为MS,不定根的诱导率为100%。在9种移栽基质中,泥炭基质中组培苗的移栽成活率最高,为100%。以绿洲3号愈伤组织预培养3 d,于农杆菌OD600值为0.1侵染10 min为宜,共培养基中添加300 μmol·L-1AS的条件下,共培养1 d的 GUS表达率最高,为1.5%。
The calli derived from Lvzhou No. 3 ( Arundo)were used as experimental material to induce adventitious buds and roots and conduct apot experiment. The calli were then used as receptors to examine the genetic transformation of Lvzhou No. 3. The results demonstrated that the most effective formula for adventitious bud induction was MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA, which exhibited an adventitious bud induction rate of 100%. The best formula for root induction was MS; the induction rate was 100%. Among nine different transplanting media, the rate of living seedling was 100% after being transplanted in peaty soil. The results showed that calli of Lvzhou No. 3( Arundo)that were precultured for 3 d, inoculated for 10 minutes, OD600=0.1, and cocultured for 1 d with 300 μmol·L-1AS are adapted for genetic transformation. The GUS expression rate might reach 1.5%.
菌草是指经过三级系统筛选法筛选出来的, 经试验证明适合用于栽培食药用菌的草本植物, 包括芒萁(Dicranopteris dichotoma)、五节芒(Miscanthus floridulus)、绿洲1号(Arund donax ‘ Lvzhou No.1’ )、绿洲3号(A. donax ‘ Lvzhou No.3’ )、巨菌草(Pennisetum sp.)等[1]。其中, 绿洲3号原产于我国福建省福州市永泰县[2], 现主要分布于我国福建、台湾、安徽等地, 以及在巴布亚新几内亚、斐济、卢旺达均有种植。绿洲3号系单子叶禾本科芦竹属植物, 植株高大直立, 根系发达, 为多年生丛生草本植物[2]。其茎杆直立、挺拔、中空, 株高通常为7 m, 茎粗约3 cm, 叶长68.0~73.5 cm, 叶宽6.6~8.0 cm, 可分枝, 每个节均能长芽[2]。
芦竹属(Arundo)植物是低洼盐碱地的“ 先锋植物” , 主要是由于它耐旱、耐盐碱的特性, 且在贫瘠的土壤里具有一定的忍耐力[3, 4]。绿洲3号作为芦竹属植物, 是荒漠化地区恢复植被的优良草种, 在沼泽地、河滩地、河岸、沙荒或旷野地都能生长, 近年来被用于福建长江地区的崩岗, 内蒙古阿拉善地区以及西藏林芝地区的防沙固沙, 与巨菌草结合, 当年就可见效。绿洲3号还是栽培多种食药用菌的优质栽培料, 用禾本植物栽培食药用菌可以大量节约木料, 有效缓解菌林矛盾。除了可作为培养食药用菌的栽培料, 绿洲3号还可作为牲畜的青贮饲料, 可用于生产乙醇、沼气、纤维板等, 同时还是优质的造纸原料。绿洲3号适宜在中国南方如福建等气候温暖的地区种植, 在寒冷的北方, 如无人工覆膜、大棚遮盖等措施很难自然越冬。在低温条件下生长缓慢甚至停止生长, 导致生长周期变短, 产量及经济效益降低, 这使得绿洲3号在北方的种植和推广受到限制, 传统的育种技术暂时无法解决此难题。生物技术如转基因、体细胞杂交等是改良绿洲3号耐寒性的有效途径, 必须首先建立绿洲3号的组织培养技术体系及转基因体系。为此, 对绿洲3号的遗传转化体系进行初步研究, 旨在为绿洲3号遗传改良奠定基础, 以便对绿洲3号在极端环境下的推广应用提供理论指导。
植物材料芦竹属绿洲3号, 由国家菌草工程技术研究中心提供。
根瘤农杆菌菌株LBA4404感受态细胞(含有利福平抗性基因Rif)和质粒pCAMBIA1301(含有卡那霉素抗性基因Kan)分别购买于上海北诺生物科技有限公司和上海捷兰生物科技有限公司。该质粒中Hyg基因为选择标记基因, GUS基因为报告基因。
1.1.1 培养基成分及培养条件 愈伤组织培养基:MS+0.5mg· L-1 6-BA+1.0 g· L-1 PVP+3.0 mg· L-1 2, 4-D。参考林志魁等[2]的方法。
培养温度控制在(25± 2)℃, 光照强度800~1 200 lx, 每天光照时间为12 h。保持培养室清洁及定期消毒。
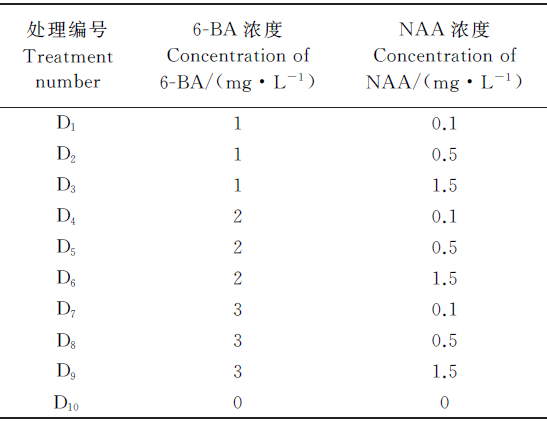
1.1.2 不定芽和不定根的诱导 在无菌条件下将培养的质地相同, 均匀一致的绿洲3号愈伤组织切成0.5~1 cm2的小块, 分别接种于含有不同浓度的6-BA和NAA的MS培养基中(表1)。每瓶中接种4块愈伤组织, 每个处理20瓶, 重复3次, 培养25 d后观察记录。
| 表1 不定芽分化和生根培养基配方 Table 1 Medium formula of adventitious bud differentiation and rooting |
1.1.3 不定芽的继代增殖 在无菌条件下将上述培养的长势良好、大小一致的绿洲3号不定芽分别接种于含有不同浓度6-BA和IBA的MS培养基中(表2)。每瓶中接种4块愈伤组织, 每个处理20瓶, 重复3次, 培养30 d后观察记录不定芽增殖情况和生长状况。
| 表2 不同浓度的生长素对不定芽增殖培养基 Table 2 Different culture media used for proliferation of adventitious buds |
1.1.4 苗的移栽 将生长良好并长出3~4 cm根的绿洲3号组培苗从培养室移出, 在室温环境下闭瓶练苗3 d后, 将瓶盖打开加入水至淹没培养基, 继续练苗3 d。随后取出小苗, 洗净根部培养基进行移栽。分别移栽至沙河、黄泥、菜园土、泥炭、菌糟、沙河∶ 泥炭(1∶ 2)、黄泥∶ 泥炭(1∶ 2)、菜园土∶ 泥炭(1∶ 2)、菌糟∶ 泥炭(1∶ 2)共9个基质中, 每个处理12株, 重复3次。3周后统计成活率。
1.2.1 试剂配制以及培养基的准备 头孢酶素(Cef)、潮霉素B(Hyg)、卡那霉素(Kan)、利福平(Rif)和乙酰丁香酮(AS)分别用0.22 μ m滤膜过滤灭菌后保存于-20 ℃。
LB固体、液体培养基, 试验其他主要培养基及组成如表3所列。
| 表3 绿洲3号愈伤组织转化所用的各种培养基 Table 3 Media used in the transformation of calli of Lvzhou No. 3 |
1.2.2 转化受体愈伤组织的准备 愈伤组织的诱导参考林志魁等[2]的方法。
1.2.3 冻融法转化根瘤农杆菌 无菌条件下, 在刚刚化冻的LBA4404农杆菌感受态细胞悬液中分别加入2 μ L需要转化的质粒DNA和2 μ L无菌水(空白对照), 轻轻混匀, 冰上放置10 min。
将离心管转入到液氮中速冻5 min, 再转移至37 ℃水浴中, 放置5 min, 期间不要晃动离心管, 然后冰浴5 min。无菌条件下加入800 μ L不加抗生素的LB液体培养基, 于28 ℃摇床上震荡培养2.5 h, 使菌体复苏。
吸取50 μ L菌液加到含有抗生素的LB固体培养基上, 用细胞涂布器涂布均匀, 对照菌液也均匀涂布于培养基, 28 ℃倒置培养72 h。对长出来的菌落进行PCR分析。
1.2.4 潮霉素(Hyg)敏感性试验 将诱导出基本一致的淡黄色致密的愈伤组织分别接种到含有0、15、30、45、60、80 mg· L-1潮霉素的继代培养基和分化培养基上, 每个处理接入30块愈伤组织, 3次重复。暗培养30 d后观察比较不同浓度的潮霉素对愈伤组织增殖和分化的影响。综合试验结果, 以确定转化过程中适合的潮霉素筛选浓度。
1.2.5 头孢霉素(Cef)抑菌浓度的确定 分别将过夜培养的LBA4404菌液20 μ L接种到含头孢霉素0、100、200、300、400、500 mg· L-1的液体LB培养基中, 每个处理重复3次。在28 ℃, 200 r· min-1条件下摇床培养48 h后, 观察记录并用分光光度计测菌液OD600值。同时将淡黄色致密的愈伤组织接种在含有0、100、200、300、400、500 mg· L-1头孢霉素的分化培养基上, 每个处理接入30块愈伤组织, 3次重复。光照培养30 d后观察比较愈伤组织分化情况。
1.2.6 农杆菌侵染与共培养 挑取转化后的农杆菌单菌落于100 mL LB液体培养基(50 mg· L-1Rif+50 mg· L-1Hyg+50 mg· L-1 Kan)中。28 ℃, 200 r· min-1摇床上培养24 h, 然后取一定量的菌液于烧杯中, 按LB∶ MS=1∶ 1比例稀释菌液, 使菌液OD600值调节到一定值(0.1、0.2、0.4、0.6 OD600)。
将预培养的愈伤组织置于上述准备好的悬浮培养基中浸泡, 期间慢慢摇动侵染一定时间(5、10、20、30 min)后倒去菌液, 用无菌滤纸吸干愈伤组织表面多余的菌液, 转接于铺有2~3层无菌滤纸的共培养基中, 于暗处28 ℃共培养一定时间(1、2、3、4 d)。
1.2.7 正交实验设计绿洲3号的转化体系 本研究选用5因素4水平的L16(45)正交实验(表4), 其五因素分别是预培养时间(0、1、2、3 d)、菌液浓度OD600(0.1、0.2、0.4、0.6)、共培养AS浓度(0、100、200、300 μ mol· L-1)、农杆菌侵染时间(5、10、20、30 min)及共培养时间(1、2、3、4 d)。试验参数参照预备试验设计, 每个试验组和接种400个绿洲3号愈伤组织, 共培养后的愈伤组织进行GUS表达率统计。
| 表4 L16(45)正交实验的处理 Table 4 The orthogonal experiment treatments |
不定芽诱导率=产生不定芽的愈伤组织数/接种的愈伤组织总数× 100%;
不定芽生根率=分化出根的不定芽数/接种的不定芽总数× 100%;
愈伤组织增殖率=增殖的愈伤组织块数/接种的愈伤组织块数× 100%;
成活率=成活的组培苗数/移栽的组培苗总数× 100%。
取以上各处理3次重复的平均值为结果数据, 运用统计分析软件SPSS 20.0进行数据的显著性检验和分析。
2.1.1 6-BA和NAA对绿洲3号愈伤组织诱导不定芽和根的影响 以MS为基础培养基, 分别添加不同浓度的6-BA和NAA进行芽和根分化培养(图1)。结果表明, D8处理的不定芽诱导率显著低于另外9个处理, 不定芽的诱导率仅为65.000%(表5), 其他9个处理之间差异不显著(P> 0.05), 以D1和D4处理的发芽率最高, 达100%, 但D4的长势差于D1。D10处理生根率显著高于其他9个处理, 为91.7%, 这说明6-BA和NAA抑制绿洲3号愈伤组织根的诱导。综上分析可得出, 绿洲3号愈伤组织不定芽的最适诱导培养基MS+1.0 mg· L-1 6-BA +0.1 mg· L-1 NAA, 根的最适诱导培养基为MS。
2.1.2 6-BA和NAA对绿洲3号不定芽增殖的影响 试验结果表明, 在不添加6-BA和IBA的MS的基本培养基中, 都没有不定芽的增殖。在添加有6-BA和IBA的9个处理增殖明显差异不大, 增殖率均达到了100%, 增殖多且长势健壮。因此, MS+1.0 mg· L-1 6-BA +0.5 mg· L-1 IBA为绿洲3号不定芽增殖的最佳培养基(图2)。
2.1.3 组培苗的移栽结果 不同移栽基质对绿洲3号组培苗移栽成活的效果不同(图3)。移栽成活率大小依次为泥炭(存活率为100%)> 河沙∶ 泥炭(1∶ 2)> 黄泥∶ 泥炭(1∶ 2)> 河沙=菜园土> 黄泥> 菌糟∶ 泥炭(1∶ 2)> 菜园土∶ 泥炭(1∶ 2)> 菌糟(存活率为20.4%); 苗的长势在含有泥炭或菌糟的土壤基质中明显的好于其他基质(表6)。可见, 泥炭基质为绿洲3号组培苗最适移栽基质。
| 表5 不定芽分化和生根培养基配方 Table 5 Medium formula of adventitious bud differentiation and rooting |
2.2.1 愈伤组织增殖对潮霉素的敏感性 15~45 mg· L-1的Hyg可促使绿洲3号根分化, 在不加Hyg和Hyg浓度在60~80 mg· L-1 的培养基中均无根的分化(表7)。接种在含Hyg的培养基上的愈伤组织增殖块数与不含Hyg的培养基相比显著(P< 0.05)下降, 15~80 mg· L-1的Hyg浓度使愈伤组织的增殖块数低于40%, 在80 mg· L-1时愈伤组织增殖块数为0(图4)。因此, Hyg比较理想的选择压浓度为80 mg· L-1。
2.2.2 愈伤组织分化对潮霉素的敏感性 在无Hyg添加的培养基中, 愈伤组织中不定芽分化率较高, 在含有Hyg添加的培养基中愈伤组织不定芽分化率为0。随着Hyg浓度的升高, 生根率先升后降且差异显著(P< 0.05)。当Hyg浓度大于60 mg· L-1时, 愈伤组织停止生长和分化, 并出现黄褐色(图5)。在45 mg· L-1的Hyg浓度下愈伤组织先增大后焦褐死亡(图5)。所以, Hyg的最适浓度为60 mg· L-1。
 | 图2 绿洲3号芽在G10和含有激素的培养基上的增殖情况Fig. 2 The propagation of Lvzhou No. 3 buds was in G10 medium and the medium with hormone |
| 表6 不同基质对绿洲3号组培苗移栽成活率的影响 Table 6 Effect of different planting media on plantlet survival rates |
2.2.3 抑菌抗生素浓度的筛选 随着抑菌剂Cef浓度的增加, 菌液OD600值显著下降(P< 0.05)。Cef分别为100、200、300、400、500 mg· L-1时, OD600值分别为0.038、0.021、0.010、0.004和0, 其抑菌效果无显著差异, 且农杆菌LBA4404的数量极少, 在500 mg· L-1时能完全达到抑制农杆菌生长(表9)。
随着Cef浓度的增加, 绿洲3号愈伤组织芽和根的分化受到的影响不大, 芽的分化率均大于88%(表10)。为更好地抑制农杆菌生长, 降低试验成本并避免浪费, 选用Cef的抑菌浓度为200mg· L-1时, 绿洲3号愈伤组织仍能高效分化出芽。由此说明, Cef可作为抑菌剂[5, 6, 7]。
2.2.4 农杆菌转化的结果 将经冻融法转化的根瘤农杆菌菌株LBA4404分别涂抹于LB基本培养基和添加50 mg· L-1利福平、50 mg· L-1潮霉素及50 mg· L-1卡那霉素的LB培养基, 同时把未经转化的根瘤农杆菌菌株LBA4404涂抹于含抗生素(利福平、潮霉素、卡那霉素)的LB培养基, 经3 d培养后观察生长情况。含有抗生素的培养基中未经转化的菌株LBA4404无生长的迹象, 而经转化的菌株LBA4404在含抗生素的LB培养基中生长速度明显低于在不含抗生素的LB培养基, 因此在含抗生素的培养基中, 菌株LBA4404成功导入质粒pCAMBIA1301。
| 表7 不同浓度的潮霉素对愈伤组织增殖的影响 Table 7 Effects of different concentrations of Hyg on callus proliferation |
| 表8 不同浓度的潮霉素对愈伤组织分化的影响 Table 8 Effects of different concentrations of Hyg on callus differentiation |
2.2.5 正交实验设计结果 将共培养的愈伤组织和未转化处理的愈伤组织进行GUS染色, 结果表明, 抗性愈伤组织表面呈蓝色, 经共培养无抗性愈伤组织呈黄色, 而未经农杆菌侵染的愈伤组织呈白色。在本研究中, 当预培养时间为3 d、OD600为0.1、添加AS浓度为300 μ mol· L-1、农杆菌侵染时间为10 min及共培养时间为1 d时, GUS表达率最高, 为1.5%, 其他条件均未发现抗性愈伤组织。
| 表9 头孢霉素对抑菌效果的影响 Table 9 Effect of cefotaxime on suppression of Agrobacterium tumefaciens |
| 表10 不同浓度的Cef对愈伤组织分化的影响 Table 10 Effects of different concentrations of Cef on callus differentiation |
分化与激素的关系同植物的遗传性有密切的关系, 而细胞分裂素与生长素的比值能影响植物的分化能力, 从而影响愈伤组织的根、芽等器官的分化[8]。唐玉林等[9]研究表明, 细胞分裂素/生长素比值高不利于根的分化, 从而也证实本研究中6-BA和NAA抑制绿洲3号愈伤组织的根分化。当添加的6-BA和NAA浓度均为0 mg· L-1时, 生根率高于其他9个处理。添加1.0 mg· L-1 6-BA和0.1 mg· L-1 NAA, 愈伤组织的不定芽诱导率和生根率均最高, 且长势良好。许多作物器官先长出根系后很难分化出不定芽[10], 故应先分化出不定芽后再进行根的诱导。综合分析, 诱导绿洲3号不定芽分化的最佳培养基为:MS+1.0 mg· L-1 6-BA+0.1 mg· L-1 NAA, 最佳生根培养基为MS。
吲哚丁酸(IBA)属于生长素类物质, 它可以促进细胞分裂, 诱导愈伤组织形成组织块。6-BA属于细胞分裂素类物质, 可以促进细胞的分裂和不定芽的形成, 打破顶端优势, 有利于形成丛生芽并增殖[11]。在植物的组织培养中, 添加的激素种类和配比对细胞的诱导分化与生长起着决定性的作用, 在一般情况下高浓度的细胞分裂素与低浓度的生长素配合使用可直接诱导外植体再生不定芽或诱导生成胚状体[12]。本研究发现, 一定浓度的6-BA和IBA均可促进绿洲3号不定芽的增殖, 在添加有6-BA和IBA的9个处理中, 不定芽的增殖差异不大, 且都达到了100%。结合成本考虑, 以MS+1.0 mg· L-1 6-BA+0.5 mg· L-1 IBA为最佳增殖培养基。
通过苗的移栽试验发现, 绿洲3号组培苗移栽入9种基质中培养一段时间后, 除含有菌糟基质的苗生长良好, 其余的均植株矮小、叶下部成紫红色。李晓强等[13]利用菌渣为原料的育苗基质, 通过加入不同体积配比的珍珠岩、蛭石, 进行番茄(Lycopersicon esculentum)、甜椒(Capsicum annuum var. grossum)、黄瓜(Cucumis sativus)的育苗, 发现菌渣和珍珠岩复合基质中菌渣含量与蔬菜壮苗指数极显著相关(P< 0.01)。在土壤中添加菌渣, 可改变土壤有机质、腐殖质含量, 有助于改善土壤结构, 促进土壤团粒结构的形成, 提高土壤肥力[14]。因此在育苗时, 应注意科学合理地组配无机基质和有机基质, 可以更好地调节育苗
基质的水分和营养状况。
转化受体系统必备的条件是较强重复性、高频率的再生率和诱导率[15]。Firoozabady等[16]利用带GUS报告基因质粒的农杆菌转化Rosa hybrida‘ Royalty’ 的茎、叶柄、花、叶及愈伤组织等, 结果表明, 只有愈伤组织转化成功。高莉萍和包满珠[17]选择月季品种‘ 萨曼莎’ 的愈伤组织和试管苗叶作为转化受体, 结果显示, 只有愈伤组织成功转化。因此, 本研究以绿洲3号愈伤组织为转化受体材料。
植物的遗传转化体系研究中, 选择剂既不可杀死植物细胞, 又需对细胞生长起到抑制作用[18, 19]。转化受体材料对抗生素有一定耐受力, 而非转化受体材料对抗生素敏感, 从而筛选出转化成功的植株。本研究所用载体质粒pCAMBIA1301含有潮霉素抗性, 绿洲3号愈伤组织对潮霉素较为敏感, 潮霉素浓度在60 mg· L-1几乎就抑制愈伤组织的分化, 在80 mg· L-1愈伤组织几乎停止生长。因此, 在绿洲3号遗传转化过程中, 选择60~80 mg· L-1潮霉素为适宜的选择剂。
植物的遗传转化中, 侵染后的受体材料表面附着有大量的农杆菌, 如果不加抗生素会使农杆菌大量的生长, 从而使受体材料死亡。抗生素能使经农杆菌侵染共培养后的受体材料脱菌, 且不影响受体材料的分化[20]。本研究采用的抑菌剂是头孢霉素(Cef), 头孢霉素是较为常用的抗生素。对抑菌剂的研究表明, 200 mg· L-1的头孢霉素浓度即可抑制农杆菌的滋生, 且对绿洲3号愈伤组织的分化没有表现出明显的毒害作用, 与姜清彬[21]使用200 mg· L-1的头孢霉素对细枝木麻黄(Casuarina cunninghamiana)遗传转化基本一致。
许多研究表明, 受体材料在农杆菌侵染之前进行预培养具有重要的意义, 可以促进伤口处的细胞分裂, 从而使外源DNA更容易整合进组织或细胞, 有利于提高转化效率[22]。在转化过程中, 通过预培养可以减少污染率, 如转化受体材料上带有病菌等, 则在预培养中可被筛选掉。预培养的时间对转化率影响显著, 如果预培养时间过长, 会使转化率下降, 可能是由于转化受体材料伤口的愈合。因此, 本研究对绿洲3号组织分别进行0、1、2、3 d的预培养时间设定, 从而进行正交实验筛选, 结果表明, 预培养时间为3 d为最适时间。
农杆菌在侵染的过程中菌液浓度过低或侵染时间过短时, 会使受体材料与农杆菌不能充分接触, 从而使转化率降低。在菌液浓度过高或侵染时间过长时会使受体材料伤口软腐坏死、褐化死亡, 且筛选培养时农杆菌不易去除, 从而影响转化率[23]。不同受体材料对菌液浓度的敏感性有一定的差异, 一般菌液浓度范围OD600在0.05~0.70之间, 侵染时间掌握在数分钟内。本研究设计的菌液浓度OD600(0.1、0.2、0.4、0.6)及农杆菌侵染时间(5、10、20、30 min), 而进行正交实验筛选。结果表明筛选的最适菌液浓度OD600为0.1, 最适农杆菌侵染时间为10 min。
研究表明, 共培养是决定遗传转化能否成功的关键, 农杆菌附着在受体材料表面后不能立即转化, 只有在受体材料伤口部位生存16 h后农杆菌才能诱发肿瘤[24]。使外源基因整合进植物基因组中需适宜的共培养时间。因此, 本研究需要对愈伤组织进行共培养, 设计共培养时间(1、2、3、4 d)。乙酰丁香酮(AS)广泛应用于农杆菌介导植物遗传转化中, 是一种酚类化合物[25]。乙酰丁香酮能诱导农杆菌VIr基因表达及活化, 从而促进T-DNA的转移[26]。由于单子叶植物伤口细胞不能释放酚类化合物, 因此本研究在共培养基中加入AS浓度(0、100、200、300 μ moL· L-1), 而进行正交实验筛选。结果表明, 在共培养基中加入的最适AS浓度为300 μ moL· L-1。
关于转化体系建立的报道已有不少, 但研究者大都针对单因素试验的效应开展研究各个因素的最佳水平[27], 而单因素试验结果的判断缺乏一定的标准和量化, 且试验过程繁琐, 从整体上考虑各因素的交换作用与综合影响不能兼顾[28]。本研究以绿洲3号愈伤组织为材料, 采用正交设计, 对农杆菌介导的绿洲3号愈伤组织遗传转化体系中的预培养时间、菌液浓度、共培养AS浓度、农杆菌侵染时间和共培养时间5因素4水平进行系统研究。最终建立农杆菌介导的绿洲3号愈伤组织转化体系:绿洲3号愈伤组织预培养3 d、菌液浓度OD600测定值为0.1、共培养的AS浓度为300 μ mol· L-1、农杆菌侵染时间为10 min、共培养时间1 d为最佳遗传转化体系。
本研究以绿洲3号愈伤组织为转化受体, 头孢霉素(Cef)最适抑菌浓度为200 mg· L-1, 潮霉素(Hyg)对愈伤组织增殖和分化最佳筛选浓度分别为80和60 mg· L-1。经农杆菌LBA404侵染和筛选培养基筛选, 最后经过GUS表达, 表达率为1.5%。与发展较完善的谷子(Setaria italica)转基因体系和水稻(Oryza sativa)转基因体系等相比, 绿洲3号的转基因成功率有待进一步的提高。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|