第一作者:韩东英(1992-),男(满族),河北承德人,在读硕士生,主要从事重金属污染植物修复研究。E-mail:[email protected]
采用盆栽试验,研究3种砷浓度下(0、10和100 mg·kg-1)老芒麦( Elymus sibiricus)和香根草( Vetiveria zizanioides)生长特征及根、茎、叶三部位砷含量变化及其细胞膜透性、抗氧化酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)]响应特征。结果表明,低浓度砷对老芒麦和香根草株高和生物量抑制不明显,高浓度下抑制显著( P<0.05),二者相比香根草对重金属砷有更好的抗性。除老芒麦叶片变化不显著外,两种植物其余部位的砷含量均随着浓度的增加而显著增加;老芒麦地上部的砷积累量随浓度的增加显著降低,香根草则表现出随浓度的增加显著升高,高浓度条件下香根草地上部的砷积累量要高于老芒麦。老芒麦根、茎、叶三部位的细胞膜透性均表现出随砷浓度增加显著升高,香根草根、叶部位表现出相同的变化趋势,但茎部的差异不显著( P>0.05)。砷胁迫引起了老芒麦根、茎、叶三部位CAT、SOD和APX活性的显著增加,而香根草这3种酶的活性能够在10和100 mg·kg-1间维持。POD活性有所不同,表现为砷胁迫引起两种植物茎、叶部位降低,根系增加。综合而言,香根草对于重金属砷有更好的抗性、更强的富集能力,并且SOD与POD可能在其抗氧化体系中起关键作用。
The effect of arsenic (As) stress (10,100 mg·kg-1) on the activity of catalase (CAT), peroxidase (POD), superoxide dismutase (SOD), and ascorbate peroxidase (APX), as well as cell membrane permeability and arsenic content in three parts (roots, stems, leaves) of Elymus sibiricus and Vetiveria zizanioides were evaluated by pot experiments. The results showed that low concentrations of arsenic had no significant inhibition on plant height and biomass of E. sibiricus and V. zizanioides, but they were significantly inhibited at high concentrations ( P<0.05). Compared with E. sibiricus, V. zizanioides exhibited better resistance to arsenic stress. The contents of arsenic in both plants increased significantly with the increase of the concentration of arsenic applied, except for that in the leaves of E. sibiricus. The accumulation of arsenic in the aerial parts of E. sibiricus decreased significantly with the increase of its concentration, whereas that of the V. zizanioides showed the opposite trend; overall, the accumulation of arsenic in the aerial parts of V. zizanioides was higher than that of E. sibiricus at high concentrations. The membrane permeability of roots, stems, and leaves of E. sibiricus all showed a significant increase with the increase of arsenic concentration, and the roots and leaves of V. zizanioides showed the same trend, although the stems of V. zizanioides did not exhibit a significant difference. Arsenic stress caused a significant increase in CAT, SOD, and APX activity in roots, stems, and leaves of E. sibiricus, whereas the activities of three enzymes in V. zizanioides could be maintained between As10 and As 100, but the arsenic stress caused the POD activity in stems and leaves to decrease and to increase in the root system. Taken together, V. zizanioides had better resistance and greater enrichment capacity to the heavy metal arsenic. SOD and POD may play important roles in the antioxidative system.
砷(As)是一种非植物生长发育必需的类金属元素[1], 其水溶性阴离子能通过液体吸收进入植物体破坏细胞[2]。砷元素的氢化物、氧化物等多数都会对人类、家畜、禽类产生很强毒性, 可能导致畸形、突变和肿瘤等不良的恶性后果[3], 目前土壤中的砷污染已成为备受关注的严重问题[4]。土壤中砷含量决定了它对植物产生的毒害, 通常土壤中较低浓度的砷含量对植物生长有刺激作用, 高浓度则对植物生长有抑制作用。高浓度砷对植物的毒害表现为:光合作用受到抑制, 影响细胞生长, 伤害根系和抑制根系活性[5], Rossman[6]认为这可能是由于高浓度砷妨碍了光合磷酸化和ATP的合成。当砷进入植物体后, 植物会产生大量的活性氧簇(ROS), 如O2-· 、H2O2及HO· 、· OH等[7], 为维护植物正常的生理代谢, 抗氧化系统、酶系统会发生适应性变化消除过多的ROS, 如产生超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽过氧化物酶(GPX)、谷胱甘肽还原酶(GR)等抗氧化酶[8], 以便维持自由基代谢的动态平衡, 从而降低细胞的损害程度, 也提高了植物的耐受性[9]。
重金属污染土壤修复治理已是生态环境建设的重要方面, 植物修复技术成本低且环保日益受到关注[10], 部分草本植物抗性强、生物量大, 且具有巨大生态价值[11], 是发展植物综合治理的潜在利用对象。老芒麦(Elymus sibiricus)为禾本科披碱草属多年生牧草, 具有抗寒、抗旱、耐盐碱、适应性强且易栽培的优良特性, 现已被广泛应用于栽培草地的建设和天然草地的植被恢复中[12]。香根草(Vetiveria zizanioides)具有易栽培、易管理、根系发达、适应性强且生物量大的特点, 多应用于水土保持、恢复生态系统等方面[13, 14]。目前, 对老芒麦的研究主要集中在盐碱胁迫、干旱胁迫等方面[15, 16]; 对香根草的研究集中在铅、锌等重金属元素上[17, 18, 19], 关于类金属元素砷污染土壤对老芒麦、香根草影响的研究较少。因此, 本研究通过分析两种砷胁迫下老芒麦和香根草耐性、砷吸收和积累特征以及抗氧化酶活性变化, 初步评价老芒麦、香根草用于矿区砷污染土壤修复的应用潜力及其体内植物的抗氧化响应。
试验土壤取自北京林业大学草坪研究所昌平试验站, 土壤类型黄壤土, 土壤pH 7.47, 质地中壤, 速效钾含量105.306 mg· kg-1, 有效磷含量30.712 mg· kg-1, 全氮含量为0.806 g· kg-1, 有机质含量16.748 g· kg-1, 总砷含量0.337 mg· kg-1。老芒麦、香根草种子来自北京正道种业有限公司; 试验中的砷为亚砷酸钠(NaAsO2)。
采取完全随机试验设计, 设置1个对照(不添加砷处理)和2个砷浓度梯度[10、100 mg· kg-1(装填混合土重, 纯砷计)]。每个处理设4个重复, 两种植物共计24盆。
在北京林业大学草坪研究所昌平试验地自建温室大棚内进行盆栽试验, 选用锥形塑料花盆(高25 cm、底径10 cm、口径25 cm), 每盆取过筛(10 mm)风干土2.8 kg, 鸡粪0.2 kg, 混合均匀装填。砷的外施采用将NaAsO2配成溶液施入, 每盆浇50 mL, 随后浇自来水(无砷元素检出)至田间持水量的60%左右, 静置两周。
老芒麦和香根草使用草炭∶ 蛭石=1∶ 1的基质育苗盘育苗, 出苗10 d后选取长势一致的幼苗洗去根际培养基质移栽至培养花盆, 每盆10株, 定株后培养60 d, 培养时间为2016年9月1日-11月1日, 期间定期定量浇水, 保持水分为田间持水量的60%左右。
1.3.1 细胞膜透性 称取植物根、茎、叶样品各0.1 g, 剪成1 cm小段, 置于试管中, 加25 mL蒸馏水, 室温下摇床上震荡24 h, 电导仪测电导率EL1。试管再次封口, 牙签扎孔通气, 沸水浴30 min后测量电导率EL2。同样方法测对照, 即不加叶片的蒸馏水的电导率EL0。
细胞膜透性=(EL1— EL0)/(EL2— EL0)。
1.3.2 抗氧化酶 称取植物根、茎、叶样品各0.15 g, 剪碎于研钵中, 加适量液氮, 研磨成粉末状; 加2 mL酶提取液(100 mL PBS7.0+1 g PVP+0.007 44 g EDTANa)研磨成匀浆, 转移到2 mL的离心管中。4 ℃条件下15 000 r· min-1离心20 min, 将上清液转移至新的2 mL离心管中, 4 ℃保存, 备用。
POD活性采用愈创木酚法, 在470 nm处测定吸光度的变化值, 酶活性单位为U· (mg· min)-1; CAT活性采用过氧化氢法, 使用分光光度计测定240 nm处吸光度的变化值, 酶活性单位为U· (mg· min)-1; APX采用H2O2法, 在290 nm处测定吸光度1 min内的变化值, 酶活性单位为U· (mg· min)-1; SOD活性采用氮蓝四唑(NBT)光还原法, 在560 nm处测定反应液吸光度值, 酶活性单位为U· mg-1。
1.3.3 株高及生物量 每盆随机选取4株植株, 将植株清洗干净后, 采用直尺直接测量株高; 生物量测定采用105 ℃杀青30 min, 80 ℃烘干至恒重, 使用千分之一天平测定植物根、茎、叶的干重。
耐受系数=(砷处理值/对照值)× 100% 。
1.3.4 砷含量 将植物样品分为茎、叶、根三部分, 80 ℃烘干至恒重后, 使用研磨仪进行粉碎, 过0.30 mm筛后使用千分之一天平准确称取0.500 g, 采取HNO3-HClO4(4∶ 1)混合酸湿法消化, 采用原子荧光光谱法[20]进行砷含量测定。
砷含量=植株某部位生物量× 植株相应部位砷浓度。
原始数据经Excel 2013软件整理, 使用SPSS for Windows 21.0统计软件进行单因素方差分析, 采用Excel 2013、OriginPro 9.0制作相关图表。
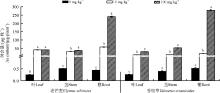
在10 mg· kg-1处理下, 老芒麦和香根草的株高与对照相比并没有显著降低; 在100 mg· kg-1处理下, 两种植物的株高均显著下降(P< 0.05), 其中老芒麦的差异率57%远远大于香根草的差异率11%。3种砷浓度条件下, 香根草的株高均高于老芒麦(图1)。
与对照相比, 老芒麦叶片和根系生物量表现出10 mg· kg-1条件下显著(P< 0.05)促进, 100 mg· kg-1条件下显著抑制的现象, 茎部的生物量在10和100 mg· kg-1条件下均表现出显著抑制的现象(表1)。香根草叶片生物量和茎生物量在10和100 mg· kg-1条件下均表现出下降, 根系生物量在10 mg· kg-1条件下并没有表现出显著性下降且10与100 mg· kg-1条件下差异不明显。100 mg· kg-1条件下, 老芒麦叶片、茎、根系耐受系数分别为13.9%、10.2%、23.8%, 香根草叶片、茎、根系耐受系数分别为73.1%、96.8%、91.7%, 香根草叶、茎、根的耐受系数均高于老芒麦。
| 表1 砷胁迫下老芒麦和香根草不同部位生物量及耐受系数 Table 1 The biomass and tolerance index of different parts of E. sibiricus and V. zizanioides under different concentrations of arsenic stress |
与10 mg· kg-1相比, 100 mg· kg-1条件下老芒麦叶片的砷含量没有显著变化(图2)(P< 0.05); 茎砷含量呈显著升高(P< 0.05), 增幅为17.2%; 根砷含量也显著增加, 增幅达到315.7%。与10 mg· kg-1相比, 100 mg· kg-1条件下香根草叶、茎、根的砷含量均呈现显著增加(P< 0.05), 增幅分别为183.4%、362.3%和1 437.63%。此外, 老芒麦和香根草均表现出根砷含量大于叶、茎砷含量。
与10 mg· kg-1相比, 100 mg· kg-1条件下, 老芒麦叶、茎、根的砷积累量显著降低(P< 0.05), 香根草叶、茎、根的砷积累量显著升高(图3)。10 mg· kg-1条件下老芒麦地上部具有更好地移除重金属砷的能力, 其叶、茎的砷积累量分别达到151.85和37.90 μ g· 株-1; 100 mg· kg-1条件下香根草地上部具有更好地移除重金属砷的能力, 其叶、茎的砷积累量分别达到57.83和60.90 μ g· 株-1。100 mg· kg-1条件下, 香根草根部的砷积累量远远高于茎叶部位, 达到了798.12 μ g· 株-1。
除10 mg· kg-1处理的茎外, 老芒麦根、茎、叶三部位的细胞膜透性均表现出100 mg· kg-1处理> 10 mg· kg-1处理> 对照, 且相互之间呈显著差异(P< 0.05)(表2)。香根草根、叶的细胞膜透性也表现出100 mg· kg-1处理> 10 mg· kg-1处理> 对照, 但茎部的差异不显著(P> 0.05)。与对照相比, 10 mg· kg-1条件下香根草叶、茎、根差异率分别为38.7%、21.3%、25.5%, 小于同等条件下老芒麦, 也小于同等处理条件下老芒麦叶、茎、根的差异率447.0%、42.4%、91.4%。
| 表2 砷胁迫对老芒麦和香根草细胞膜透性的影响 Table 2 Effect of arsenic stress on the cell membrane permeability of E. sibiricus and V. zizanioides |
老芒麦叶片的APX、CAT和SOD活性均表现出100 mg· kg-1处理> 10 mg· kg-1处理> 对照, 且相互之间呈显著差异(P< 0.05), 但POD活性则呈现出对照> 10 mg· kg-1处理> 100 mg· kg-1处理(图4)。香根草叶片的抗氧化酶活性与老芒麦的变化基本一致, 不同点是其APX和SOD活性10和100 mg· kg-1处理间并没有表现出显著差异(P> 0.05)。
老芒麦茎、根的APX、CAT、SOD活性变化与叶片趋势一致, 也表现出100 mg· kg-1处理> 10 mg· kg-1处理> 对照(图5、图6), 除了老芒麦茎部CAT活性在10和100 mg· kg-1间不显著外(P> 0.05), 其余均呈显著差异(P< 0.05)。香根草茎、根的APX、CAT和SOD活性变化与老芒麦有相同的趋势, 但香根草茎部APX和CAT活性较稳定, 根、茎两部位的SOD活性10和100 mg· kg-1间均并没有表现出显著差异。POD活性有所不同, 两种植物茎、叶的POD活性表现出0 mg· kg-1处理> 10 mg· kg-1处理> 100 mg· kg-1处理, 而香根草根的POD维持在一个稳定状态, 老芒麦根POD活性表现出100 mg· kg-1处理> 10 mg· kg-1处理> 对照。
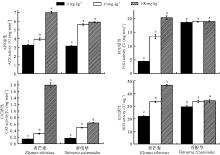 | 图4 砷胁迫对老芒麦和香根草叶片抗氧化酶活性的影响Fig. 4 Effect of arsenic stress on leaf antioxidant enzymes of E. sibiricus and V. zizanioides |
 | 图5 砷胁迫对老芒麦和香根草茎抗氧化酶活性的影响Fig. 5 Effect of arsenic stress on stem antioxidant enzymes of E. sibiricus and V. zizanioides |
砷对植物的影响存在浓度效应[21], 刘全吉等[22]通过对小麦(Triticum aestivum)的研究表明, 0~30 mg· L-1砷会对小麦的生长产生轻微的抑制, 当砷浓度达到90 mg· L-1时, 小麦的生长受到了明显的影响, 趋于死亡。也有研究表明, 茶树的生长和光合作用表现出低浓度砷(≤ 25 mg· kg-1)促进、高浓度砷(50 mg· kg-1)明显抑制的“ 低促高抑效应” [23]。在本研究中, 高浓度砷(100 mg· kg-1)对老芒麦和香根草的株高产生明显的抑制效果, 但在低浓度(10 mg· kg-1)条件下, 两种植物的株高并没有明显的变化。同样, 高浓度砷对两种植物各部位的生物量也产生显著抑制, 特别是老芒麦叶片、茎、根系耐受系数仅为13.9%、10.2%、23.8%, 植物趋于死亡。这与前人的研究[21]保持一致, 说明砷对植物的生长产生了破坏, 并且伴随浓度的提升, 这种破坏作用明显增强。Danh等[24]在研究中发现香根草对砷具有极高的忍耐程度, 可以达到78 mg· kg-1, 而一般作物对砷的忍耐程度只有10~30 mg· kg-1。本研究发现, 即使在高浓度(100mg· kg-1)条件下, 香根草叶片、茎、根系耐受系数也能够达到73.1%、96.8%、91.7%, 可以正常生长, 因此香根草表现出对重金属砷更好的耐性和抗性。我国砷矿资源分布广泛, 农田、草地也面临着严峻的重金属污染的威胁[25, 26], 香根草由于其优异的耐砷性可更多地的用于废弃矿山的植被恢复。当植物受到重金属胁迫时, 会通过吸收一部分重金属并将其固定在液泡内来减少重金属对叶片细胞的损害, 这是植物抵抗重金属的一种机制[27, 28]。在本研究中, 相对于低浓度砷, 高浓度砷条件下老芒麦茎叶砷含量没有显著升高, 根系砷含量显著升高。高浓度条件下老芒麦生长受到严重抑制可能是根系砷含量的增加而引发的植物生理代谢紊乱造成的, 而茎叶砷含量可能在低浓度条件下就达到了植物吸收的阈值, 因而并没有发生显著变化。香根草根、茎、叶三部位砷含量在高度浓度条件下均显著增高且植物能够正常生长, 这体现了香根草对砷良好的富集潜力、转运能力和耐受性。另外, 相对于低浓度条件, 高浓度条件下两种植物根砷含量均极显著增加(P< 0.01), 这可能是由于植物的根部首先接触到重金属土壤, 然后再转移到植物的茎叶部分, 因而根系细胞会储存更多的砷以保护植物[29]。由于植物的地上部比根系更容易收获, 因而植物地上部重金属浓度以及地上收获物的重金属积累量通常被作为评价污染清除程度的主要指标[30]。在本研究中, 两种植物茎叶的砷含量随着浓度的增加而增加, 生物量随浓度的增加而下降。结果表现出老芒麦地上部的砷积累量随砷浓度的增加而显著降低, 香根草地上部的砷积累量随浓度的增加而显著升高。高浓度(100 mg· kg-1)条件下, 老芒麦地上部(茎和叶)的砷积累量为20.625 μ g· 株-1, 远远小于香根草的118.737 μ g· 株-1, 香根草具有根系发达、生物量大的特点[14], 廖芳芳等[31]研究发现, 香根草植物对煤矸石山砷有富集作用。综合而言, 香根草对砷有更好的耐性、积累特征并在砷污染地的植物修复中有一定的潜力。
植物细胞膜对维持细胞的代谢起着重要作用, 逆境条件下细胞膜透性体现了植物对于逆境的抵抗能力[32, 33]。在本研究中, 两种植物各部位的细胞膜透性均表现出随砷浓度增加而增加的现象, 这是由于膜质过氧化程度加剧, 细胞膜受到了由重金属引起的过氧化损伤[34]。在相同处理条件下, 香根草根、茎、叶细胞膜透性的差异率均低于老芒麦, 这反映了砷胁迫下香根草根、茎、叶细胞膜受到的损伤要低于老芒麦, 香根草根、茎、叶细胞膜对重金属砷有更好的适应性和抵抗性, 这也是香根草对砷有良好抗性的原因之一。植物在受到重金属胁迫时, 体内会产生大量的活性氧, 影响植物正常的生理代谢。SOD的作用是将超氧阴离子歧化成H2
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|