第一作者:张亚玲(1991-),女,山西大同人,在读硕士生,主要从事饲草栽培与加工研究。E-mail:[email protected]
紫花苜蓿( Medicago sativa)是世界上种植面积最大、应用最广泛的豆科牧草。由于其耐盐性中等,其在我国北方地区的产量和种植受到土壤盐渍化的限制。因此提高紫花苜蓿的耐盐性具有重要的科学和生产意义。为此,以龙牧801紫花苜蓿( M. sativa ‘Longmu 801’)为试验材料,采用实时荧光定量PCR技术分析了不同浓度NaCl胁迫下9个盐胁迫蛋白质组筛选出的盐响应相关基因的表达模式。结果显示,处理时间和处理浓度对9个基因的相对表达量均有显著性影响,表明这9个基因均在紫花苜蓿盐胁迫应答中发挥着一定作用。处理1 h时, G6PI、 ABP19a、 Trx-h1、 PR bet 1、 FBPA、 6PGDH和 ALDH这7个基因的相对表达量在不同NaCl胁迫浓度处理的紫花苜蓿中均显著上调, RRM和 GDPD在NaCl处理2 h后开始上调。除 G6PI基因,其他8个基因在0.4% NaCl处理下相对表达量显著高于0.2%和0.8% NaCl处理。这些基因参与糖代谢、信号转导和胁迫响应。以上结果表明,紫花苜蓿的耐盐性极其复杂,涉及到多基因的表达和代谢通路的调控。研究结果有助于全面研究并了解紫花苜蓿的盐响应相关基因的表达模式,促进紫花苜蓿耐盐分子育种。
Alfalfa is the most-cultivated and most widely used forage legume in the world. Its moderate salt tolerance limits its cultivation and production in Northern China because of the soil salinization in this area. Therefore, improving alfalfa salt tolerance is important for both scientific research and commercial production. In this study, we used Medicago sativa ‘Longmu 801’ as a model to analyze the expression patterns of 9 salt response genes selected for salt stress proteomics using quantitative real-time PCR under various NaCl concentrations. The results showed that time and NaCl concentration had significant effects on the relative expression of all 9 genes, indicating that these 9 genes play roles in alfalfa’s salt stress response. The relative expression levels of G6PI, ABP19a, Trx-h1, PR bet 1, FBPA, 6PGDH, and ALDH genes were all significantly up-regulated in alfalfa treated with the tested NaCl stress concentrations for 1 h. RRM and GDPD were obviously up-regulated after 2 h of NaCl treatment. Except G6PI, the relative expression of the remaining 8 genes under 0.4% NaCl stress was much higher than that under 0.2% and 0.8% NaCl stress. These genes are mostly involved in carbohydrate metabolism, signal transduction, and stress response. This result demonstrated that alfalfa’s salt tolerance is complicated and is a result of multi-gene expression and the interactions of many metabolic pathways. This result is useful for further research on alfalfa salt response genes and selective breeding of alfalfa using molecular markers.
土壤盐碱化是造成全球作物产量降低和品质下降的主要非生物胁迫之一。盐渍化土地是我国重要的、具有潜在利用价值的边际土地资源, 总面积约有3 667万hm2, 其中盐渍化耕地近670万hm2, 约占全国总耕地的5%[1, 2]。由于气候变化和农牧业生产活动的影响, 我国盐碱化土壤的面积呈现日益扩大的趋势, 而土地盐碱化造成的土壤理化性质变差、土地利用率降低、草地产量下降等问题严重威胁到农牧业生产和生态环境建设[3, 4]。
牧草是可持续农业的重要组成部分, 随着我国农业结构调整, 草地畜牧业的发展使苜蓿在牧草产业中成为主导产业。紫花苜蓿(Medicago sativa)产量高、品质好、适应性强, 是全球性栽培的豆科苜蓿属多年生草本植物, 长期以来在生态治理、畜牧业发展和种植业结构调整中发挥着重要作用[5, 6]。但盐胁迫会显著降低紫花苜蓿的产量, 培育耐盐新品种是降低盐渍化土地对紫花苜蓿生长和产量影响的有效途径[7, 8]。
植物的耐盐性是一个非常复杂的数量性状, 涉及到多基因和多种耐盐机制的协调作用[9, 10]。随着分子生物学的发展和转基因技术的进步, 植物抗逆性研究已从传统的生理指标测定转变为对其分子机理的阐释[11, 12]。Winicov和Button[13]分析了盐胁迫对紫花苜蓿光合作用相关基因表达的影响, 结果显示, 光合作用相关叶绿体基因psdD、psaB、atpB、rbcL以及核基因pCab4、pCab1、rbcS在紫花苜蓿中的表达增强。因此, 全面研究并了解紫花苜蓿的盐相关基因的表达模式有助于紫花苜蓿耐盐分子育种。为此, 基于盐胁迫下紫花苜蓿蛋白质组数据, 通过生物信息学分析筛选出9个盐响应相关蛋白, 在美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)中Blast其对应的编码基因序列, 采用Primer Premier 5.0软件设计引物, 用荧光定量PCR分析不同浓度NaCl胁迫处理、不同处理时间后其在紫花苜蓿中的表达模式, 研究结果可为紫花苜蓿耐盐研究提供候选基因, 并为研究其耐盐分子机制奠定基础。
试验用紫花苜蓿种子为龙牧801(Longmu 801), 由东北农业大学动物科学技术学院草业科学实验室提供。
选取籽粒饱满、健康的紫花苜蓿种子, 用5%的次氯酸钠消毒10 min, 蒸馏水冲洗4~5次后置于铺有滤纸的培养皿中, 放入人工培养箱中暗培养, 相对湿度60%~75%, 培养温度25 ℃/20 ℃(日/夜), 待苜蓿子叶展开后转入自制的苜蓿培养槽中, 用改良的Hoagland营养液水培[14], 每2 d换一次培养液。二周龄的紫花苜蓿幼苗转入NaCl浓度为0、0.2%、0.4%、0.8%的营养液中进行盐胁迫处理, 处理时间分别为0、1、2、4、8 h, 取整株幼苗为试验材料, 样品立即进入液氮中冷冻处理并储存在-80 ℃冰箱中直至使用。每个处理设4个生物学重复。
紫花苜蓿幼苗总RNA用TIANGEN的RNAprep Pure 植物总RNA提取试剂盒提取, 用1%琼脂糖凝胶检测其完整性(图1a), 用微量分光光度计进行浓度的测定。RNA的反转录用的HiScript Ⅱ Q Select RT SuperMix for qPCR (+gDNA wiper) 试剂盒(Vazyme, 中国)进行, cDNA质量用Taq酶(Vazyme, 中国)进行普通PCR鉴定(图1b)。
盐响应相关基因的选择以前期获得的紫花苜蓿盐胁迫下差异表达蛋白质组数据为基础[4], 通过生物信息分析差异蛋白的分子功能、参与的生物过程和代谢通路, 然后筛选出9个盐响应相关蛋白, 并在NCBI中Blast其对应基因的编码序列和登录号, 获得盐响应相关基因(表1)。
| 表1 9个盐响应相关基因的KEGG通路注释 Table 1 KEGG path annotation of nine salt-tolerance genes |
实时定量PCR以紫花苜蓿肌动蛋白基因β -Actin作为内参, 紫花苜蓿9个盐响应相关基因为目的基因, 采用Premier 5.0进行引物的设计(表2), 荧光定量PCR用ABI7500实时荧光定量PCR仪完成整个试验, 反应体系(20 μ L):10 μ L 2× ChamQ SYBR qPCR Master Mix(Vazyme-ChamQ SYBR qPCR Master Mix), ROX Reference Dye 2(50 X) 0.4 μ L, cDNA 1 μ L, 终浓度为10 μ mol· L-1的上下游引物各0.4 μ L, dd H2O 7.8 μ L。反应结束后, 通过检测溶解曲线来确定PCR产物的特异性, 采用Livak和 Schmittgen[15]提出的2-Δ Δ ct计算基因在不同处理下的相对表达量。
| 表2 实时荧光定量PCR引物序列 Table 2 Primer sequences used for RT-PCR |
用Excel 2003进行数据前期处理, 用SPSS 19.0软件对数据进行统计分析, 用Origin 8进行绘图。
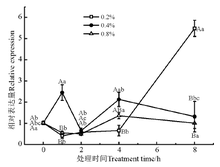
葡萄糖-6-磷酸异构酶(glucosamine-6-phosphate isomerase, G6PI)是催化葡萄糖-6-磷酸和果糖-6-磷酸(Fru6P)的可逆相互转化的细胞内酶。处理时间和浓度对G6PI基因的表达均有明显影响(图2)。NaCl处理1 h时, 各浓度下G6PI基因的表达量均显著上调(P< 0.05)。0.2% NaCl处理下, G6PI基因的表达量呈先升高后降低再升高的波动性变化; 0.4% NaCl处理下, G6PI基因的表达量在4 h 时达到高峰; 0.8% NaCl处理下, G6PI基因的表达量显著高于其他浓度的处理。
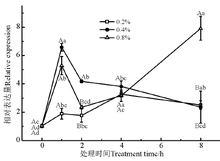
生长素结合蛋白(auxin-binding protein, ABP)是广泛存在于高等植物中的生长素类物质, 对植物生长发育有调节作用。NaCl处理浓度和时间均对ABP19a的表达量有显著影响(P< 0.05)(图3)。NaCl处理1 h时, 0.4% NaCl胁迫下, ABP19a的表达量先显著上调(P< 0.05), 然后逐步下降; NaCl处理2 h时, 0.4%和0.8% NaCl胁迫的紫花苜蓿中ABP19a的表达量显著上调; 0.2% NaCl胁迫下, ABP19a的表达量从4 h开始显著上调(P< 0.05), 8 h时的表达量是其他浓度处理下的6倍。
硫氧还蛋白(Thioredoxin, Trx)是具有催化活性二硫键的小型普遍存在的蛋白质。NaCl处理浓度和时间对Trx-h1的表达量都有显著影响(P< 0.05)(图4); 处理1 h时, 除0.2% NaCl胁迫外, 其他浓度处理下Trx-h1的表达量均有显著上调(P< 0.05), 且0.4%NaCl胁迫下上调幅度更大; 0.2% NaCl胁迫下Trx-h1基因的表达量随时间无显著变化; 0.8% NaCl胁迫下, Trx-h1基因的表达量先显著上调, 4 h后显著下调。
病程相关蛋白(pathogenesis-related proteins, PR)是植物体在受到真菌、细菌和病毒等病原菌入侵或受到非生物胁迫后产生的一种或几种上调蛋白, 广泛存在于单子叶和双子叶植物中。如图5所示, NaCl胁迫1 h时, 各浓度处理与对照相比均有显著性上调(P< 0.05), 0.4% NaCl胁迫下的PR bet 1家族蛋白基因的表达量最大, 是同一时间点其他浓度处理的4倍; 在0.2% NaCl胁迫下, PR bet 1家族蛋白基因的表达量在NaCl胁迫处理1 h时表达量最大。
甘油磷酸二酯磷酸二酯酶(glycerophosphoryl diester phosphodiesterase, GDPD)催化甘油磷酸二酯类物质水解为甘油-3-磷酸(G-3-P)和相对应的醇类。如图6所示, NaCl胁迫处理1 h时, 3个处理浓度较对照都有显著性变化(P< 0.05); 处理4 h后GDPD基因的表达量均显著升高; 不同浓度处理之间, 0.2% NaCl胁迫下GDPD基因的表达量变化最显著; 在时间处理上, 4 h是该基因表达量大幅上调的节点, 8 h该基因表达量都显著上调(P< 0.05)。
果糖-二磷酸醛缩酶(fructose-bisphosphate aldolase, FBPA)是生物体内碳代谢及糖代谢途径中的关键酶之一。NaCl处理浓度和时间对FBPA基因的表达量均有显著性影响(P< 0.05); 0.2% NaCl胁迫下, FBPA的表达量随时间无显著变化(P> 0.05); 0.4% NaCl胁迫下, FBPA的表达量在2 h最大; 0.8% NaCl胁迫下, FBPA的表达量在2 h显著上调, 在4 h时达到最大, 并显著高于其他处理浓度和处理时间(图7)。
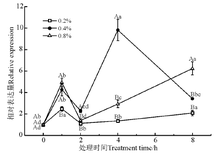
RNA识别基序(RNA recognition motif, RRM), 被称为核糖核蛋白共有序列(RNP-CS)或RNA结合结构域, 在植物基因表达和调控中起关键作用。如图8所示, NaCl处理浓度和时间对RRM基因的表达量都有显著影响(P< 0.05)。0.2% NaCl胁迫下, RRM基因的表达量在胁迫初期有显著上调; 0.4% NaCl胁迫下, RRM基因的表达量在2 h大幅上调, 4 h表达量达到最大; 0.8% NaCl胁迫下, RRM基因的表达量在2 h大幅度上调, 8 h的表达量显著高于其他处理浓度(P< 0.05)。
6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase, 6PGDH)是戊糖磷酸途径的一个关键的限速酶。如图9所示, NaCl浓度和处理时间对6PGDH基因的表达均有显著影响(P< 0.05); 在NaCl胁迫处理1 h时, 6PGDH基因的表达量均显著增加, 且0.4%的浓度处理较其他2个浓度表达量更高; 而0.8% NaCl胁迫下, PGDH基因的表达量在2 h后显著上调, 在8 h时最大。
G6PI参与糖酵解、戊糖磷酸、糖异生、糖原合成和葡萄糖醛酸等途径[16], 并且可以作为响应诸如硝酸盐等环境因素的刺激的信使[17]。Eunsoo等[18]通过在烟草(Nicotiana tabacum)中短暂过量表达芒草葡萄糖-6-磷酸异构酶基因(G6PI), 增强了烟草中的抗氧化代谢相关基因的表达, 并且在盐胁迫诱导下G6PI基因表达显著增加。Cui等[19]发现, DsGPI基因受盐度的强烈诱导, 且盐度越高, 诱导效果越强, 表明DsGPI可能在耐盐性中起重要作用。本研究中, 盐处理4 h后0.8%和0.4%浓度处理下G6PI基因表达开始下降, 0.2%的表达量开始上升, 表明高浓度的盐更能诱导G6PI基因的表达, 且不同时间的处理对其也有显著影响。
生长素结合蛋白(ABP)通过生长素调节过程中的信号转导途径, 参与生长素调节的植物生长发育过程[20]。研究表明, 生长素类物质可通过促进幼苗快速生长来缓解盐胁迫[21]。Zolla等[22]研究发现, 盐胁迫通过调控生长素浓度梯度和再分配影响拟南芥的侧根数、侧根和初生根生长及根的生长方向。在本研究中, 盐处理对ABP19a基因的表达有显著影响, 0.2%和0.4%浓度的盐处理对于基因表达量的影响更加显著; 盐胁迫1 h时, 0.4%的盐浓度的胁迫显著诱导该基因的表达, 可能是在受到中浓度的盐胁迫时, 该基因参与生长素的调节过程, 缓解盐胁迫。
硫氧还蛋白在植物的抗逆系统中起较重要的作用[23]。研究发现, OsTRXhl的表达受盐处理的诱导, 在OsTRXhl过表达植株中, 盐处理所引起的细胞质外体的活性氧的积累与野生型相比明显减少, 而OsTRXhl的RNAi植株的质外体中活性氧含量较多[24]。本研究中, 盐胁迫1 h时, 0.4%和0.8%盐处理下基因的表达量都显著增加, 0.4%盐胁迫下Trx-h1基因的表达量变化更为显著, 表明该浓度的盐更能诱导该基因的表达。
PR家族在不同植物中表现为几丁质酶、葡聚糖苷酶、蛋白酶抑制剂、内肽酶和过氧化物酶等, 在植物自我防御机制中作为可诱导组分发挥作用[25, 26]。研究发现, 葡萄(Vitis vinifera)品种Razegui中的RzPR10蛋白受盐胁迫诱导[27]。本研究中PR bet 1基因, 在盐胁迫1碱h时各个盐胁迫的表达量都有显著的上调, 0.4%的NaCl处理上调尤为显著, 表明该基因对中高浓度的盐胁迫更加敏感。
GDPD参与甘油及G-3-P代谢, 通过水解甘油磷酸二酯为细胞提供所必需的G-3-P[28, 29]。在植物中有关GDPD及其相关生理功能的研究报道很少。有研究报道, GDPD-like (glycerophosphodiester phosphodiesterase-like)可能参与了非生物逆境的生理应答[30]。本研究发现, GDPD基因与紫花苜蓿的耐盐性相关, 在盐胁迫1 h时各浓度处理下该基因的表达量都显著增加, 表明该基因盐胁迫后期对于耐盐机制有重要作用, 可能是由于GDPD参与甘油和G-3-P代谢相关。
在植物中, 果糖二磷酸醛缩酶参与糖酵解、糖异生以及磷酸戊糖途径, 并在碳代谢、糖代谢等过程中发挥着不可或缺的作用[31]。利用芯片杂交技术对干旱和盐胁迫条件下的大麦(Hordeum vulgare)转录水平上的变化研究结果表明, 处理后大麦根中的果糖二磷酸醛缩酶的基因表达量发生上调变化[32]; 而通过Real-Time PCR方法对TaFBPA基因的表达模式的研究结果表明, 在短期盐胁迫下, TaFBPA基因发生明显的上调表达[31]。这与本研究中FBPA基因对于盐胁迫的响应一致, 基因的表达量在短期盐胁迫下显著上调, 表明在盐胁迫初期, 低盐更能诱导FBPA基因的表达。
RRM可通过与具有广泛亲和力和序列特异性的RNA结合, 参与RNA代谢, 并与多种蛋白质结构域相互作用[33], 参与植物发育和应激反应, 有时用作蛋白质或RNA分子伴侣[34]。Kwak等[35]研究显示, ORRM5表达对冷胁迫或盐胁迫条件有反应, 但其对盐处理的反应不太显著。本研究中不同盐浓度和处理时间显著影响RRM基因的表达, 表明RRM与多种蛋白质结构域相互作用来参与了盐胁迫的机制。
6PGDH可调节生物代谢产物, 抵抗外界环境破坏, 进而通过增强糖代谢途径提高作物的抗逆性[36]。有研究显示, 苹果6PGDH受到盐胁迫不同程度的诱导[37]; 也有研究证明, Os6PGDH1的转录水平受高盐、低温、干旱和ABA等非生物胁迫的诱导[38]; 本研究结果显示, 紫花苜蓿中6PGDH受盐胁迫的显著诱导, 且中高浓度的盐对于基因的诱导更加显著, 可能是通过提高基因的表达增强糖代谢途径, 产生耐盐相关物质。
ALDH能够将外源和内生的脂肪醛和芳香醛不可逆的氧化为相应的羧酸, 对提高植物抗干旱、抗盐碱和清除活性氧等能力具有重要作用[39, 40]。有研究表明, 过量表达ALDH的转基因拟南芥, 其抗盐胁迫能力提高, 且转基因植株的ROS含量显著低于野生型, 表明醛脱氢酶在细胞代谢和逆境生理方面可能具有重要作用[41, 42]。本研究显示盐胁迫对于该基因的表达有显著的诱导, 不同浓度NaCl胁迫下紫花苜蓿ALDH基因的表达量都显著增加, 可能是通过基因的表达将体内的一些物质氧化为相应的羧酸, 清除活性氧降低其对植物的伤害。
本研究结果表明, 处理时间和处理浓度对9个紫花苜蓿耐盐相关基因的表达量均有显著影响, 即使同一个基因在不同强度的盐胁迫处理中的表达也不相同, 这说明在不同盐胁迫条件下, 苜蓿有不同的策略来应对盐胁迫, 以保证自身正常的生长和发育。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|