第一作者:张世超(1991-),女(满族),吉林省吉林市人,在读硕士生,主要从事牧草种质资源与遗传育种研究。E-mail:[email protected]
以紫花苜蓿( Medicago sativa)不育系MS-GN-1A为母本,恢复系MS178为父本组合构建BSA分离群体,获得的F1代均表现为雄性可育,在大田种植了221株F2代群体单株,盛花期将花粉颗粒染色后,显微镜下观察统计出,不育的F2代株数为57,可育F2代株数164,并没有观察到半不育植株。将所有植株划分为可育和不育两组,并构建可育和不育DNA混池,混池DNA从可育和不育植株组DNA中各随机抽取20个样品,以此对恢复基因定位。随机挑选160对已知的四倍体苜蓿SSR引物扩增基因池DNA,获得2个具有多态性的分子标记,分别是Mt2c12、AW166,初步定位 Rf基因在类群Composite5上。将类群Composite5上的所有引物进行合成,进一步进行引物筛选,最终获得4个具有多态性的标记BI68、Mt2c12、BG267和AW776153,遗传距离分别为19.0、20.9、44.6和72.1 cM。
In this study, alfalfa CMS MS-GN-1A was used as the female parent, and the restorer line MS 178 was used as the male parent to construct BSA separate groups. All products of F1 were male fertile. There were 221 plants in the F2, and the number of sterile plants was 57, with 164 fertile, and no semi-sterile plants were found. Based on the results of the fertility microscopy, the separate population was divided into two groups, fertile and sterile group; the genomic DNA of the fertile and sterile groups were extracted and 20 samples of DNA from each group were randomly selected and mixed into a fertile and sterile gene pool for the positioning of restoring genes. The experiment randomly selected 160 pairs of known tetraploid alfalfa SSR primers. To amplify the gene pool DNA, two molecular markers with polymorphism (Mt2c12 and AW166) were obtained, and were initially positioned on a composite of five primers. All primers on this group were synthesized, and the designed primers were screened again. Finally, four markers with polymorphism were obtained: BI68, Mt2c12, BG267 and AW776153, with a genetic distance of 19.0 cM, 20.9 cM, 44.6 cM, and 72.1 cM, respectively.
紫花苜蓿(Medicago sativa)杂种优势较强。在生产中, 为了使这一优势得到广泛的利用, 授粉的控制体系尤为重要, 保证它的稳定性和高效性十分必要, 雄性不育(male sterility)是最具有代表性的途径之一[1]。其中的细胞质雄性不育(cytoplasmic male sterility, CMS)更易于找到保持系从而实现“ 三系” 配套, 应用前景十分广阔[2, 3]。2000年以来, 如何综合利用转基因和分子标记等遗传技术对苜蓿CMS进行研究[4]成为热点。如, Barcaccia等[5]利用RAPD技术, 对减数分裂过程中苜蓿的突变体进行标记, 找到了许多具有特异性标记的突变体, 并通过这些特异性标记对突变体中的2n配子形成机制进行了新的研究, 并用QTL技术将二倍体苜蓿群体的大花粉基因(jumbo pollen, jp)定位于6号染色体上, 推测出形成多核小孢子的基因在6号连锁群上。Rosellini等[6]成功将雄性不育基因Bamase转入苜蓿, 发现影响花粉正常发育的原因主要是胼胝质酶的合成与分泌, 因此可通过改变胼胝质酶的含量也能得到雄性不育植株。
由于杂交种的生产涉及一些商业秘密, 针对紫花苜蓿细胞质雄性不育的理论研究较少, 多集中在细胞核[7], 对选育紫花苜蓿的新杂交品种推动不大。而2008年通过卫星搭载公农1、2、3号紫花苜蓿后代, 新发现紫花苜蓿雄性不育材料(MS-GN)[8], 其特性表现为无花粉或花粉败育[9]。在不育系(MS-GN)的基础上, 进一步杂交育种, 成功获得4份紫花苜蓿雄性不育系材料, 其不育特性近100%且十分稳定[8]。再将已获得的材料不断运用回交、测交的方式, 终于选育出3份不育率超高的保持系材料(后代不育率高于95%)[8], 这3份材料对细胞质雄性不育特性有稳定的高维持性, 对今后雄性不育方向的理论研究和应用价值起到了至关重要的作用。但在紫花苜蓿细胞质不育遗传基础、遗传模式和不育机理上需要进一步研究, 尤其在优良恢复系筛选等方面也需要进一步探索。
本研究对不育系MS-GN-1A的不育特征进行分析, 利用SSR分子标记法, 以不育恢复基因所在的引物类群为基础, 完成初步定位, 以期对未来紫花苜蓿雄性不育系的研究提供一点参考和理论依据。
以吉林省农业科学院于洪柱等[8]选育的紫花苜蓿不育系MS-GN-1A为母本, 恢复系MS178为父本配置杂交组合产生F1代(144株), 在 2014年获得杂交F1代种子, 2015年将F1代种子种植于大田中。使用人工方式强迫自交获得F2代种子, 2016年种植于大田中, 得到F2代分离群体(221株)。
1.2.1 花粉育性鉴定 在紫花苜蓿开花盛花期, 取父母本、F1和F2代群体单株未开放的小穗于冰盒中, 带回实验室。采用花粉染色I2-KI染色法进行染色, 于显微镜下观察花粉育性情况[10, 11]。育性观察统计并计数以后, 并取父母本、F1和F2代群体的单株的叶片提取 DNA 用于连锁分析[12]。
1.2.2 叶片DNA的提取和PCR反应 根据试剂盒说明进行叶片DNA的提取, 将提取后的DNA置于在-20 ℃储存备用。PCR扩增产物用 30%变性聚丙烯酰胺凝胶电泳后, 进行核酸燃料染色后观察统计并拍照。
1.2.3 多态性标记的筛选 参照F2育性观察结果分析, 结合田间植株表现[13], 将所有植株划分为可育和不育两组, 并构建可育和不育DNA混池, 混池DNA从可育和不育植株组DNA中各随机抽取20个样品。
通过已发表的紫花苜蓿遗传图谱中公布的SSR引物 (共8条连锁群296个SSR引物)[14], 随机选取160条作为初步筛选的引物。通常在 SSR-PCR 反应完成后, PCR 产物会先经过琼脂糖凝胶电泳检测其质量, 并进行多态性条带鉴定, 而后再进行聚丙烯胺凝胶电泳。观察基因池之间的扩增条带是否存在多态性。
初次验证筛选引物后发现含有多态性位点的染色体连锁群, 找到这一条染色体上的所有引物序列。以上引物均根据文献中提供的引物序列[14], 由上海生工生物技术公司合成引物。
1.2.4 电泳条带统计与重组率计算 在显微镜下观察 F2群体单株是否可育, 并结合田间形态观察的结果, 确定F2单株所表现的基因型。将可育单株的基因型标记为“ A” , 不育单株的基因型标记为“ B” 。同时利用具有特异性的SSR引物对F2单株基因组进行扩增, 对扩增产物进行聚丙烯酰胺凝胶电泳, 并进行核酸染料染色, 对得出的结果进行统计分析。如果扩增出的群体单株目的基因条带与不育基因池相同, 那么将此条带标记为“ B” , 若与可育基因池条带相同, 则标记为“ A” , 如果条带与不育和可育基因池均不相同(杂合型), 则标记为“ H” 。统计条带后做成Excel表格, 再通过遗传作图软件Joinmap 4.0构建遗传图谱, 将3.0作为 LOD 最小值, 最大遗传距离为 50 cM。
淀粉与I2-KI溶液反应, 在显微镜下呈现为深蓝色。可育的花粉粒可以合成淀粉, 显微镜下可以看到深蓝色的花粉颗粒细胞, 反之不育株的花粉不能被染色, 呈现为黄色或浅褐色。有些植株在盛花期的花药中, 并没有花粉颗粒的存在, 所以也就不能被I2-KI染成深蓝色。这说明在植株生长发育至开花期, 一部分植株的花粉粒没有正常合成, 导致花药在发育过程中就发生不正常的改变, 最终形成不育植株[15]。
于盛花期对大田种植的221株F2代群体单株花粉颗粒染色后, 显微镜下观察统计出, 不育的F2代株数为57, 可育F2代株数164, 并没有观察到半不育植株。
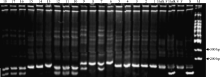
2.2.1 SSR引物的筛选 首先对随机挑选的160对引物(从296对引物中随机选出)进行PCR扩增反应, 结果发现, 所有引物都能扩增出多条条带, 但其中具有特异性的扩增产物有2对。分别是Mt2c12和AW166。图1为 Mt2c12和AW166 的所在位置, 即部分引物的筛选结果, 6号引物Mt2c12和7号引物AW166其扩增产物具有特异的多态性。
 | 图1 部分引物初步筛选结果 M, 100 bp ladder.图2, 图3同。Fig. 1 Initial screening results of partly screened SSR primers Marker in Figure 2 and Figure 3 is the same as Figure 1. |
根据文献[14]中的引物, 将有多态性条带的引物在文章中找到相应的类群Composite5, 将该类群上所有引物进行合成, 现已完成该类群的引物筛选, 结果在两个基因池间发现了5个具有多态性的 SSR 引物, 分别为Mt2c12、AW166、BI68、AW776153和BG267。图2为BI68和BG267所在组中部分引物筛选结果。
2.2.2 恢复基因定位 把Mt2c12、BI68、AW776153和BG267分别作为扩增引物, 发现相对应的分别有21、16、32和28株扩增条带与其对应的基因池不同(即为交换), 其他个体的 DNA 扩增条带均与其对应基因池相对应(图3为BG267的部分电泳条带)。将所有数据统计分析输入软件后, 结果如图4所示, 与恢复基因连锁的SSR引物 BI68、Mt2c12、BG267和AW776153, 它们的遗传距离分别为 19.0、20.9、44.6和72.1 cM。并且与恢复基因连锁最为紧密的是引物BI68。
 | 图4 紫花苜蓿细胞质雄性不育恢复基因Rf的遗传连锁图Fig. 4 Composite genetic linkage map of 5 primers of cytoplasmic male sterile restorer gene in alfalfa |
在筛选引物过程中, 择优选取, 挑选与恢复基因Rf较近的引物, 所以, 在最后遗传作图的时候, 隐去了AW166这个引物。
本研究使用紫花苜蓿不育系MS-GN-1A为母本, 恢复系MS178为父本做组合构建BSA分离群体, 所获得的F1代均表现为雄性可育, 在大田种植了221株F2代群体单株, 盛花期将花粉颗粒染色后, 显微镜下观察统计出, 不育的F2代株数为57, 可育F2代株数
164, 并没有观察到半不育植株。本研究通过筛选紫花苜蓿细胞质雄性不育恢复基因紧密连锁的SSR分子标记, 进行染色体定位和不育恢复基因的定位分析, 首先找到2条引物Mt2c12、AW166具有多态性条带, 找到相应的染色体, 将所有引物进行合成、筛选、定位后发现, 与恢复基因连锁的SSR引物BI68、Mt2c12、BG267和AW776153, 遗传距离分别为19.0、20.9、44.6和72.1 cM。其中BI68与恢复基因连锁最为紧, 将恢复基因定位于Composite5连锁群上。细胞质雄性恢复基因的定位是紫花苜蓿杂种优势利用的基础[16]。随着分子标记越来越迅速的发展及其被更加广泛的应用, 许多主要农作物用于分子标记的指纹图谱被系统化、全面化[17], 这也是分子标记定位到目前为止, 在各种农作物的育性基因定位的试验中, 科学研究者首选方法的原因[18]。目前, 越来越多物种的微卫星标记图谱密度的增加和技术都得到了很好的发展[19], 微卫星标记技术将在基因定位中发挥更大的作用[20]。因此本研究采用SSR标记和BSA法来定位紫花苜蓿恢复系MS178的恢复基因。虽然19.0所cM是一个较远的标记, 但是为进一步精细定位提供了基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|