第一作者:徐舶(1990-),女(满族),辽宁沈阳人,在读博士生,主要从事牧草遗传育种研究。E-mail:[email protected]
花药组织培养再生体系的构建是单倍体育种的重要途径之一。本研究对呼伦贝尔黄花苜蓿( Medicago falcate ‘Hulunbeier’)进行了花药组织培养研究并建立了花药组培再生体系。结果显示,液体悬浮培养基比固体培养基更适合呼伦贝尔黄花苜蓿花药愈伤组织的培养,其愈伤形成的培养条件为B5培养基+0.5 mg·L-1 2,4-D+0.25 mg·L-1 6-BA+0.4 mg·L-1 NAA+3.0 mg·L-1 KT;分化培养基为MS+1.0 mg·L-1 2,4-D+0.5 mg·L-1 6-BA+2%蔗糖+0.7%琼脂;生根培养基为1/2MS+0.1 mg·L-1 NAA+2%蔗糖+0.7%琼脂;获得的再生植株经流式细胞仪鉴定,其单倍体比例高达27%。
The establishment of a regeneration system using the anther tissue culture method is an important approach in haploid breeding. In the present study, the anther tissue culture of Medicago falcata ‘Hulunbeier’ was investigated and the regeneration system of anther tissue culture established. The results showed that liquid suspension medium was more suitable than solid medium for M. falcata in the induction of anther callus. Mixtures of B5+0.5 mg·L-1 2,4-D+0.25 mg·L-1 6-BA+0.4 mg·L-1 NAA+3.0 mg·L-1 KT, MS+1 mg·L-1 2,4-D+0.5 mg·L-1 6-BA+sucrose 2%+ager 0.7%, and 1/2 MS+0.1 mg·L-1 NAA+sucrose 2%+ager 0.7% were suitable for callus induction, callus differentiation, and rooting culture, respectively. The percentage of haploids of regenerated plants was measured by flow cytometry as being 27% for M. falcata.
苜蓿(Medicago sativa)是世界上种植最广泛的饲料作物之一, 提高苜蓿饲草产量和营养价值是苜蓿育种的主要目标[1]。利用苜蓿雄性不育系配制杂交种, 可以提高种子产量, 同时可利用杂种优势提高抗性, 选育新品种。杂种优势育种除了双亲遗传组成的适当差异外, 还要以纯合品种为前提。要进一步选育苜蓿纯合品种, 仅靠常规的育种手段难以奏效, 需借助花药[2]与花粉组织培养得到单倍体植株[3], 单倍体加倍后培育出双单倍体, 利用双单倍体(即纯合品种)与雄性不育系配制杂交种, 可获得强优势的杂交种F1代。
黄花苜蓿(M. falcate)抗逆性强, 适于我国寒冷草原地区种植, 具有重要的生态和经济价值[4], 适宜作为杂交组配的父本材料, 因而借助花药组织培养的方式获得纯合的黄花苜蓿材料具有重要的意义。目前虽有很多关于黄花苜蓿组培体系的研究[4, 5, 6, 7, 8], 但组织培养体系并不完善, 国内也未见获得单倍体以及双单倍体黄花苜蓿的报道。因此, 本研究以呼伦贝尔黄花苜蓿(Medicago falcate ‘ Hulunbeier’ )为材料, 建立花药组织培养的高效再生体系, 鉴定出单倍体, 以期为双单倍体的培养奠定基础[9]。
试验材料为呼伦贝尔黄花苜蓿, 种子由呼伦贝尔草原站提供, 于2015年种植在内蒙古农业大学新校区牧草试验地。4-5月, 选择处于单核靠边期(花蕾长至1~3 mm)的花蕾, 将带有枝条的花序剪下装入纱网袋, 带回实验室备用。
本试验所用激素均由西格玛奥德里奇(上海)贸易有限公司提供, 纯度均在95%以上。培养基由Chembase公司提供, 蔗糖为天津大茂公司提供的分析纯试剂, 琼脂由Biosharp公司提供。
1.2.1 诱导愈伤组织培养基的配比 采用固体及液体悬浮培养两种培养方式。以B5为诱导花药愈伤培养基, 参考前人试验结果[4, 10]设置各培养基的激素配比, 选用L16(44)正交表(表1)。其中固体培养加蔗糖30.0 g· L-1 , 琼脂7.0 g· L-1 , pH 5.8。液体悬浮培养加蔗糖30.0 g· L-1 , 0.01 g· L-1活性炭, pH 5.8。
| 表1 呼伦贝尔黄花苜蓿花药诱导愈伤组织培养正交试验的各因素水平 Table 1 The level of various factors in the orthogonal test of induction callus culture of Medicago falcata ‘ Hulunbeier’ anthers |
1.2.2 固体培养基花药诱导愈伤组织方法 灭菌处理:将带有枝条的花序装入纱网袋, 在流水下冲洗30 min, 超净工作台中用70%酒精消毒30 s, 然后用无菌水冲洗2次, 0.1% HgCl2溶液消毒3 min, 无菌水冲洗3次, 置于无菌培养皿中待用。
接种:选择单核靠边期花蕾, 消毒后用解剖针剥开花蕾, 取出花药分别接种到培养基上, 每个培养基上接种15个花药, 各8个重复。
1.2.3 液体悬浮培养基花药诱导愈伤方法 花序消毒后(消毒方法同前), 选择单核靠边期花蕾, 用解剖针剥开小花蕾取出花药, 接种在液体培养基中。每个培养基上接种10个花药, 各6个重复。置转速110 r· min-1、25 ℃的摇床中暗培养60 d。
1.2.4 愈伤组织的分化培养 固体培养和液体悬浮培养出的愈伤组织, 均转入固体分化培养基继续培养。在崔楠[11]试验的基础上稍作改进, 在分化培养基中添加了6-BA, 分化培养基组成如表2所列, pH 5.8, 蔗糖20.0 g· L-1, 琼脂7.0 g· L-1。每瓶接种5块愈伤组织, 各5个重复, 20 d继代一次。
| 表2 愈伤分化培养基 Table 2 Medium for shoot development |
1.2.5 分化苗的生根培养 以诱导出的分化苗为材料进一步筛选适宜的生根培养基, 培养基组成如表3所列, pH 5.8, 蔗糖20.0 g· L-1 , 琼脂7.0 g· L-1。
| 表3 苜蓿花药培养植株的生根培养基 Table 3 Rooting media for cultured alfalfa plants |
1.2.6 结果观察与统计方法 固体培养从花药接种30 d后, 统计出愈率; 液体悬浮培养从花药接种60 d后, 统计出愈率。愈伤组织增殖培养一次(30 d)后转入分化培养基, 分化出绿苗后统计分化率。
出愈率=(产生愈伤组织块数/接种花药数)× 100%;
分化率=(分化出芽点的愈伤组织数/接种愈伤组织总数)× 100%;
生根率=(生根植株数/接种分化苗总数)× 100%。
利用Excel软件处理基础数据, SAS(9.0)软件进行方差分析。
1.2.7 倍性鉴定 通过贝克曼流式细胞仪(Beckman coulter cytoFLEX)对呼伦贝尔黄花苜蓿花药培养再生植株进行倍性鉴定。对照材料为:已知倍性扁蓿豆(Medicago ruthenica)(2n=16)无菌苗, 草原1号杂花苜蓿(Medicago varia ‘ Caoyuan No.1’ )(2n=32)无菌苗。
前处理方法参考高霞[12]的操作过程, 略有改进。样品破碎后, 转速1 000 r· min-1, 离心5 min。PI染色15 min。
在488 nm荧光的激发下, 测定PE通道待测样的荧光强度, 利用Cyt Expert软件进行分析, 根据峰值位置确定所测植株的倍性。
在16个激素配比组合中, 花药在液体培养条件下有56.3%的组合出愈率为0, 而固体培养基下均表现出一定的出愈率(1.67%~26.67%)(表4)。A5液体悬浮培养条件下的出愈率(70.00%)明显高于A14固体培养的出愈率(26.67%), 同时, 花药愈伤组织形成时间在液体培养中(60 d)较固体培养下的时间(20 d)长。
| 表4 不同培养方式和激素配比下呼伦贝尔黄花苜蓿花药培养的出愈率 Table 4 Callus induction rate in the anther tissue culture of different culture methods and hormone ratio on Medicago falcata ‘ Hulunbeier’ |
在液体悬浮培养条件下, 由各激素的R值可知, 对花药的出愈率影响较大的激素是2, 4-D(表5)。呼伦贝尔黄花苜蓿在0.5 mg· L-1 2, 4-D浓度下悬浮培养花药的出愈率均高于不同2, 4-D浓度下固体培养花药的出愈率。综合考虑不同培养方式和激素配比的影响, 呼伦贝尔黄花苜蓿花药悬浮培养的适宜条件为B5培养基+0.5 mg· L-12, 4-D+0.25 mg· L-1 6-BA+0.4 mg· L-1NAA+3.0 mg· L-1 KT+3%蔗糖+0.01 g· L-1活性炭。
| 表5 呼伦贝尔黄花苜蓿花药液体悬浮培养出愈率的极差 Table 5 Range analysis of callus rate in the liquid culture of the anther of Medicago falcata ‘ Hulunbeier’ |
为了探索用于愈伤组织分化的最佳激素组合和配比, 将0.2 mg· L-1NAA和1.0 mg· L-12, 4-D分别与两个浓度水平的6-BA(0.5 mg· L-1和1.0 mg· L-1)进行组合(表6)。结果显示, 2, 4-D与6-BA的组合对呼伦贝尔黄花苜蓿愈伤组织的分化作用优于NAA与6-BA的组合。其中, 2, 4-D 1.0 mg· L-1+6-BA 0.5 mg· L-1的组合对呼伦贝尔黄花苜蓿愈伤组织的分化诱导高达88%。
呼伦贝尔黄花苜蓿在Ⅲ 号培养基下生根率(87%)显著高于其余3种培养基(表7)。同时, 其分化率在0.1
mg· L-1NAA的培养基下显著高于0.2 mg· L-1NAA的培养基(P< 0.05), 说明相对的低浓度NAA有利于分化苗的生根培养(图1)。因此, 分化苗适宜生根培养基为1/2MS培养基+0.1 mg· L-1 NAA+2%蔗糖+0.7%琼脂。
| 表6 不同培养基上呼伦贝尔黄花苜蓿愈伤组织的分化率 Table 6 Callus differentiation rate in four medium types for Medicago falcata ‘ Hulunbeier’ |
| 表7 不同培养基上的生根率比较 Table 7 Comparison of rooting rate in the callus in four types of medium |
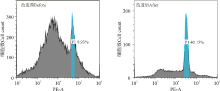
采用改进后的前处理方法, 转速1 000 r· min-1, 离心5 min, PI染色15 min, 图谱主峰明显, 碎片减少(图2)。以已知倍性扁蓿豆(2n=16)无菌苗、草原1号杂花苜蓿(2n=32)无菌苗为对照(CK)进行倍性鉴定, 固体培养方式下培养的再生植株(10株)均为四倍体, 无单倍体(表8); 而在液体悬浮培养方式下再生植株(15株)中单倍体为27%(图3)。
 | 图2 前处理改进前(左)后(右)流式细胞仪鉴定图谱Fig. 2 Flow cytometry identification map before (left) and after (right) the improvement of processing |
 | 图3 呼伦贝尔黄花苜蓿花培再生植株流式细胞仪鉴定图谱Fig. 3 Flow cytometry identification map of anther culture regenerated plants |
| 表8 呼伦贝尔黄花苜蓿花药培养再生植株倍性检测结果 Table 8 Result of ploidy detection of anther culture regenerative plants of Medicago falcata ‘ Hulunbeier’ % |
激素组合与浓度配比是诱导花药愈伤组织出愈率高低的重要影响因素[13], 以多花黑麦草特高(Lolium multiflorum ‘ Tetragold’ )和多年生黑麦草四季(L. perenne ‘ Four seasons’ )的种子为外植体, 激素组合为2, 4-D +6-BA 时能明显降低组培污染率, 且能分别得到65.52%和63.55%的最高愈伤组织诱导率[14]; 以杂交狼尾草(Pennisetum americanum× P. purureum)的种子为材料进行试验, 发现种子愈伤组织分化的最佳激素组合为0.5 mg· L-1 NAA+3.0 mg· L-1 6-BA, 分化率可达62.5%[15]。由此可见, 生长素与细胞分裂素的合理搭配是提高花药愈伤组织诱导率和分化率的关键[16]。黄竣和姜彦秋[5]以黄花苜蓿下胚轴和子叶为材料诱导愈伤组织, 发现2, 4-D是诱导愈伤的关键激素[17], 激素组合为2, 4-D 1.0 mg· L-1+6-BA 0.2 mg· L-1时出愈率最高, 2, 4-D 0.2 mg· L-1+6-BA 0.5 mg· L-1时分化率最高(20%)。伊风艳等[4]选用相同的材料做外植体诱导愈伤组织, 但分化培养基选用了NAA和KT的组合, 得出, 下胚轴是诱导愈伤及分化的最佳外植体, 诱导率可达100%, 分化率可达80%。本研究表明, 2, 4-D与6-BA对呼伦贝尔黄花苜蓿花药愈伤组织的分化率有显著的提高, 激素配比为2, 4-D 1.0 mg· L-1+6-BA 0.5 mg· L-1 时分化率达到88%, 高于伊风艳等[4]、黄竣和姜彦秋[5]的结果, 这与外植体及材料不同有一定的关系。
陈爱萍等[18]以液体悬浮培养的方式, 通过观察小孢子的存活率和诱导率, 建立了苜蓿游离小孢子培养体系, 小孢子存活率达到30.1%。姚喜红等[19]采用固液培养基结合的方式建立苜蓿花药悬浮培养体系, 培养液组合为NB+2, 4-D 0.3 mg· L-1 +NAA 0.3 mg· L-1时悬浮细胞增殖最快。可见, 不同的培养方式对苜蓿花药培养影响较大。
本研究中, 呼伦贝尔黄花苜蓿花药在液体培养中60 d才形成愈伤组织, 而固体培养下20 d便可形成愈伤组织, 说明不同培养方式下花药愈伤组织形成时间不同[20], 固体培养较液体悬浮培养下花药愈伤组织形成时间短[21]。虽然液体悬浮培养花药愈伤组织形成
周期较长, 但在花药培养中单倍体植株出苗的频率增高, 在培育过程中, 液体悬浮培养下单倍体比例(27%)高于固体培养条件下的单倍体比例(0)。高霞[12]在固体培养下苜蓿花培苗单倍体所占比例(16%)低于本研究结果, 这可能是因为液体悬浮培养可以使花药充分接触培养基, 提供花药愈伤组织形成所需的养分, 并且摇床震荡可以在培育过程中使花粉散落出来形成花粉愈伤组织, 提高单倍体比例, 同时固体培养条件下单倍体比例的差异可能是由材料不同即基因型不同所致。
倍性鉴定是单倍体育种的关键环节, 是构建双单倍体的基础[22]。花药培养得到不同倍性的植株只有经倍性鉴定后才能进行下一步的育种研究。通过流式细胞测定法进行倍性鉴定可以缩短鉴定时间[23], 但不同的测定部位、前处理方法对结果图谱影响很大[24]。耿小丽等[25]利用流式细胞仪对苜蓿愈伤组织DNA含量进行测定, 由于愈伤组织结构较松散, 所以图谱虽主峰明显但有效细胞数较少。高霞[12]通过二步离心法鉴定苜蓿花培再生植株倍性, 所得图谱杂峰较多, 这是由于前处理时间过长造成的。本研究选取再生植株的幼嫩叶片, 采用一步离心法, 转速1 000 r· min-1, 离心5 min, 同时缩短PI染色时间(15 min)[26], 可以有效减少碎片和粘连的影响, 主峰值明显, 有效细胞数量多, 也可避免DNA的降解和PI染液的分解, 图谱清晰。
1)呼伦贝尔黄花苜蓿花药组织培养适于液体悬浮培养, 其愈伤形成的培养条件为B5+0.5 mg· L-1 2, 4-D+0.25 mg· L-1 6-BA+0.4 mg· L-1 NAA+3.0 mg· L-1 KT; 分化培养基为MS+2, 4-D 1.0 mg· L-1+6-BA 0.5 mg· L-1+2%蔗糖+0.7%琼脂; 生根培养基为1/2 MS+0.1 mg· L-1 NAA+2%蔗糖+0.7%琼脂。
2)利用流式细胞仪鉴定再生植株倍性时, 应选择幼嫩的叶片, 同时缩短前处理时间, 可较为准确地鉴定出组织的染色体倍性; 液体悬浮培养再生植株中单倍体占27%。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|




