第一作者:胡进玲(1991-),女,甘肃白银人,在读博士生,主要从事植物病理学研究。E-mail:[email protected]
本研究采用PDA平板暴露法对草类植物微生物实验室的无菌间和常规操作间进行微生物收集与检测,并对主要菌种采用形态学和分子生物学鉴定,确定其分类地位。比较酒精喷雾、超净台擦拭等操作前后无菌间杂菌菌落数变化情况。研究表明,本实验室共检测到11种主要杂菌,包括解淀粉芽孢杆菌( Bacillus amyloliquefaciens)、海迪茨氏菌( Dietzia maris)、球形节杆菌( Arthrobacter globiformis)等8种细菌和青霉( Penicillium sp.)、壳皮盘菌( Peziza ostracoderma)、枝孢样枝孢霉( Cladosporium cladosporioides)3种真菌。其中,优势菌种依次为玫瑰色库克菌( Kocuria rosea)、球形节杆菌、海迪茨氏菌,菌落总数分别为28、28、23个。研究还发现,本实验室无菌间的杂菌种类远多于常规操作间,且包含了常规操作间所有杂菌种类,说明常规操作间的杂菌可能来源于无菌间,而检测到的杂菌种类主要为土壤微生物和植物病原菌,与报道的空气中常见微生物种类差异较大,说明无菌间的杂菌可能是微生物研究过程中操作不当引起。对无菌间进行除菌操作后,超净台内部杂菌种类减少了64%,超净台外部杂菌种类减少9%。因此,彻底擦拭超净工作台的内外、喷洒酒精等操作可有效减少微生物培养过程中造成的污染。从杂菌来源来看,规范试验操作,减少实验室内外空气流动也十分必要。本研究为实验室微生物污染物的检测、预防及控制提供了科学依据。
In this research project, the potato dextrose agar (PDA) plate exposure method was used to collect microorganisms from a sterile room and from a conventional operation room in a microbiology laboratory. The main strains were identified by morphological and molecular morphology. Changes in the bacterial colony after sterile operations, such as spraying with alcohol or wiping the table, were observed. Research showed that the laboratory had a total of 11 kinds of contaminating microorganism, including Bacillus amyloliquefaciens, Dietzia maris, and Arthrobacter globiformis. Altogether, there were eight kinds of bacteria and three kinds of fungi, namely Penicillium sp., Peziza ostracoderma, and Cladosporium cladosporioides. Among them, the dominant strains were Kocuria rosea, A. globiformis, and D. maris, with the colonies numbering 28, 28, and 23, respectively. The study found that the kinds of microorganism of sterile room where placed three ultra clean bench more than conventional operation room, and contains all kinds of conventional operation room. The study indicated that the microbes in the conventional operation room came from the sterile room. There was a large difference between the microorganism species of the laboratory and the common microbial species in the air, indicating that the microbes of the sterile room may have been introduced by improper operations during microbial research. After carrying out sterile operations, the contaminant microorganisms of the inside and the outside of the ultra-clean benches were reduced by 64% and 9%, respectively. The experiments show that wiping out the ultra-clean bench and spraying alcohol can effectively reduce the pollution of microbial cultures. Based on the microbial source, it is necessary to standardize the operation and reduce the air flow between the laboratory and outside. This study provides a scientific basis for the detection, prevention, and control of microbial contamination in a microbiology laboratory.
微生物实验室是指进行微生物研究的场所, 主要用以检测、分离、培养、保存各类有致病性的真菌、细菌、病毒等微生物或植物内生真菌、根瘤菌等有益微生物。微生物实验室要求无菌环境, 除研究人员目标菌种之外的其他真菌和细菌均统称为杂菌。实验室培养的微生物一旦被杂菌污染, 轻者需要重新培养, 严重则延缓试验进程, 重者丢失宝贵的菌种, 致使科研失败[1, 2]。
随着国家和社会对科学研究的大力投入, 越来越多的工作者加入到科学研究的队伍中, 因此各院校办学规模不断扩大, 学生人数逐年增加, 但高校实验教学硬件滞后, 实验室普遍存在着人员密集、实验室空间狭小、实验用品使用频率极高等情况, 造成其污染系数增加[3, 4]。我国首部《病原微生物实验室生物安全管理条例》已于2004年11月12日经国务院发布实施, 这标志着我国对病原微生物相关实验室的生物安全管理的高度重视[5], 广大学者在实验室微生物污染管理等方面也进行了大量有意义的探索[6, 7], 但主要还是集中于临床医学, 而对于植物病原微生物实验室中杂菌的污染及来源研究较少, 目前就植物病原微生物实验室污染杂菌种类及预防措施知之甚少。
兰州大学草地农业科技学院某微生物实验室某一时期也出现了杂菌严重污染培养的微生物的情况, 为确定杂菌种类及其来源, 本研究以该微生物实验室为研究场所, 对植物病原微生物实验室的杂菌进行检测, 并且结合形态学和分子生物学对主要污染物进行鉴定, 确定其种类。通过将检测到的菌种与空气中常见微生物进行对比以及将无菌间和常规操作间菌物种类进行对比, 分析杂菌来源, 以期做到有针对性的预防。本研究旨在为微生物实验室微生物污染的预防、科研环境的改善提供科学依据。
微生物实验室由两部分组成, 无菌间和常规操作间。无菌间并排放置3台超净工作台, 每个超净工作台台面和工作台下地面设为采样点, 各采样点3个重复; 常规操作间主要由15 m2的长方形试验台组成, 设置4个采样点, 分别位于试验台的每个角上。
采用平皿暴露法收集实验室污染的杂菌[8], 在无菌间的3台超净台内部和超净台地面分别随机摆放3皿马铃薯琼脂培养基(potato dextrose agar, PDA), 在常规操作间的试验台4个拐角分别放一皿PDA, 同时揭开培养皿盖子, 放置5 min后盖上盖子。
用灭菌后的潮湿抹布彻底擦拭超净台内外, 喷洒75%的酒精于超净台内部, 并用灭菌滤纸再次擦拭, 然后用干净的拖把将无菌间内的地面充分拖2遍, 随后打开3台超净工作台电源开关, 将风速调为中档吹10 min, 关掉电源之后收集超净台内和地面的微生物, 方法同1.2。
1.4.1 微生物培养 将收集微生物的培养皿封口, 于微生物培养箱内在22 ℃的环境下培养48 h, 按照菌落颜色和菌落形态统计每个平板中所见菌落数, 并按采样点分类登记, 纯化杂菌的菌落, 再培养6 d后观察菌落特征, 采用形态学和分子生物学鉴定菌种。
1.4.2 主要污染菌物鉴定 选择菌落总数大于等于2的菌物进行形态学和分子生物学鉴定[9]。细菌的16 S序列扩增参考胡进玲等[10]的方法。真菌全基因组使用真菌 DNA 提取试剂盒(型号为D3195-1), 用引物ITS1(AGGAGAGTCGTAACAAGGT)和ITS4(TCCTCCGCTTATTGATAT GC) [11, 12], PCR扩增程序为:体系20 μ L体系, 具体为0.5 μ L模板DNA, 0.5 μ L引物ITS1, 0.5 μ L引物ITS4, 10 μ L Eco taq mixture, 8.5 μ L ddH2O。反应条件为裂解95 ℃, 2 min, 退火至53 ℃, 20 s, 复性72 ℃, 1 min 40 s, 重复35个循环, 最终延伸72 ℃, 7 min, 扩增结束后以4 ℃保存[12]。然后基于BLAST软件对所测得序列和NCBI中的核酸序列进行比对分析, 找出与目的序列同源性高且通过正式发表的序列用于系统发育分析, 再采用MEGA6以邻接法(neighbor-joining, NJ)对其构建系统发育树。设置1 000次随机抽样, 计算自引导值(bootstrap), 以评估系统发育树的置信度[10, 13]。
将杂菌进行纯化, 并在培养箱中培养6 d, 通过菌落颜色和形态特征统计出现的杂菌种数和菌落数。结果显示, 供试培养皿中菌落总数大于等于2的微生物有11种, 通过其在PDA中的形态特征(如图1), 可以
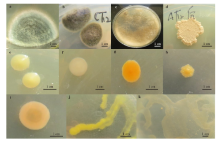 | 图1 111号污染菌物在培养皿里的菌落形态 ak分别代表111号污染物菌落。Fig. 1 Colony morphology of No.1No.11 fungal contaminants in petri dish ak represents the microorganism colony of No.1No11. |
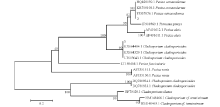
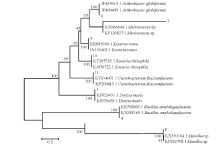
判断, 其中有3种真菌、8种细菌, 将其编号为111号, 通过菌落形态和显微观察, 确定1号污染物为青霉(Penicillium sp.), 而其他杂菌未知, 故对211号微生物进行进一步鉴定。通过观察2、3号真菌的分生孢子和分生孢子梗形态(图2), 结合其分子生物学鉴定结果(图3), 确定2号真菌为壳皮盘菌(Peziza ostracoderma), 3号真菌为枝孢样枝孢霉(Cladosporium cladosporioides)。通过分子生物学鉴定, 确定411号细菌分别为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、海迪茨氏菌(Dietzia maris)、球形节杆菌(Arthrobacter globiformis)、微球菌属(Micrococcus sp.)、马西利亚菌属(Massilia sp.)、玫瑰色库克菌(Kocuria rosea)、嗜根考克氏菌(K. rhizophila)、萎蔫短小杆菌(Curtobacterium flaccumfaciens) (图4)。
通过统计与鉴定, 本研究发现(表1), 病原微生物实验室中造成污染的优势菌种依次为玫瑰色库克菌、球形节杆菌、海迪茨氏菌、青霉、微球菌属, 菌落总数分别为28、28、23、15、13个, 是最主要的防范对象。通过形态和显微镜观察, 本研究发现, 3种污染真菌生长速度快, 产孢迅速且孢子量极大, 对微生物实验室的环境威胁极大。通过对实验室中无菌间和试验台空间的污染物检测, 本研究发现, 无菌间的杂菌种类远多于试验台空间, 且包含了所有试验台空间的污染菌种类。因此, 结果表明, 造成微生物试验污染最严重的地方为无菌间, 在日常试验过程中应对其进行严格灭菌。
| 表1 微生物菌落在供试培养基中出现情况 Table 1 Microbial colonies in the test medium |
对无菌间的超净台进行无菌抹布擦拭、喷洒酒精、开机吹风等操作后, 超净工作台面5种优势菌中, 4种彻底消失, 剩余1种平均菌落数减少了66.67%; 对于超净工作台面全部杂菌而言, 处理前后杂菌种类下降了64%, 处理前后均有的3种菌(枝孢样枝孢霉、球形节杆菌、马西利亚菌属)经处理后菌落数量分别下降了50%、67%和0; 超净工作台地面擦拭后杂菌种类减少了9%, 未彻底清除的菌中, 青霉、枝孢样枝孢霉、解淀粉芽孢杆菌等7种杂菌的平均菌落数减少, 减少范围为29.73%80.36%(表2)。因此, 彻底擦拭超净工作台、喷洒酒精等操作可有效减少微生物培养中的污染。
| 表2 除菌操作前后超净台11种菌平均菌落数 Table 2 The average colony count of 11 strains before and after sterile operation |
本研究采用PDA平板暴露法结合微生物形态学和分子生物学鉴定, 可以快速准确地统计出实验室的污染菌, 通过将检测到的菌种与空气中常见微生物对比, 分析杂菌来源, 在对污染物充分了解的情况下进行有针对性的预防。本研究在微生物实验室检测到的菌中, 青霉和马西利亚菌被报道广泛分布于自然界空气中[14], 其余菌种均不是空气中常见微生物[15, 16], 说明该实验室污染的主要原因不是由实验室内外空气流通引起的。据报道, 球形节杆菌、微球菌属、海迪茨氏菌主要分布于土壤中, 分别用于修复污染农田、硝酸还原、降解原油污染[17, 18, 19]; 壳皮盘菌、枝孢样枝孢霉为腐生真菌, 主要存在于土壤, 枯萎植物及粪便中[20, 21]; 玫瑰色库克菌、嗜根考克氏菌、萎蔫短小杆菌为3种病原菌, 主要危害植物种子、根部和叶片[22, 23, 24]; 解淀粉芽孢杆菌为一种植物内生细菌, 生防效果明显[10, 25]。因此可以确定, 这些杂菌可能是研究人员在微生物研究过程中操作不当引起的污染。从杂菌来源来看, 严格规范试验操作是减少污染最主要的途径, 因为污染菌中也有空气中常见两种菌, 因此减少实验室的内外空气流动也十分必要。
对于目前实验室已有杂菌, 应采用有效除菌操作。本研究中的除菌操作虽为常规除菌操作, 但可以将超净台内青霉、壳皮盘菌、解淀粉芽孢杆菌、海迪茨氏菌、微球菌属、玫瑰色库克菌和萎蔫短小杆菌完全清除, 将枝孢样枝孢霉等两种菌的菌落数减少, 可见除菌效果明显。因此在日常微生物试验中, 常规除菌操作必不可少。本研究发现, 该方法操作不仅简单, 而且能高效除菌, 其原因在于试验前打开超净工作台吹风, 使用灭菌湿抹布擦拭超净台内外, 用灭菌拖把清洁超净台周围地面, 这些操作可将一些生长于仪器表面或地面的污染物清除, 且制造相对潮湿的试验环境, 减少真菌孢子的飞溅传播[26, 27], 同时, 超净台吹风可将浮游在空气中的微生物或孢子吸附进入超净台下方的过滤器中[28], 避免造成试验污染; 试验前喷洒75%的酒精于超净台内, 可同时杀死空气中和仪器表面的微生物[29, 30]。
虽然通过超净台擦拭、酒精喷雾、拖地等常规除菌操作可以使超净台内9种杂菌的平均菌落数减少, 但在除菌操作前后差异不显著, 因此在微生物试验过程中, 必须结合其他灭菌措施, 比如紫外灭菌。紫外线对微生物的DNA 及RNA具有强大破坏力, 使微生物丧失生存和繁殖能力从而消灭细菌、病毒, 达到消毒灭菌成效[31, 32, 33, 34]。据夏祖英和汪国珍[35]报道, 距离1 m, 15 W紫外线照射空气2 h, 可以完全消灭超净台里的污染菌, 因此在试验人员晚上离开实验室时, 可以打开无菌间和常规操作间的紫外灯, 对实验室的空气进行彻底灭菌。因为在本研究中, 被检测到的11种主要污染菌种中, 其中8种为细菌污染物, 因此在试验允许的前提下, 可以在培养基中加一定量的抗生素, 比如青霉素、链霉素等, 来预防细菌的污染[36, 37]。其次, 正确的试验操作方法也可避免试验污染, 如在靠近酒精灯周围空间进行微生物试验, 酒精灯外焰的加热温度为400500 ℃, 可杀死其周围空气里的浮游微生物及孢子[38, 39]。
综上所述, 采用PDA平板暴露法结合微生物形态学和分子生物学进行鉴定, 可以快速准确地鉴定出实验室的污染菌种类, 分析出杂菌主要来源, 做出有针对性的预防。该方法不仅适用于微生物实验室, 在医学实验室、分子实验室和植物组织培养室的微生物污染检测、鉴定、预防等方面都具有重要的借鉴意义[40, 41, 42]。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|