第一作者:徐孟(1990-),女,山东济南人,在读硕士生,主要从事园林植物栽培生理研究工作。E-mail:[email protected]
在土壤压实胁迫条件下,研究丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)对高羊茅( Festuca arundinacea)生理的影响。结果表明:4种土壤压实梯度下,与未接种对照相比,接种AMF处理高羊茅叶片超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、抗坏血酸过氧化物酶(APX)活性、硝酸还原酶(NR)活性均不同程度高于未接菌处理,而丙二醛(MDA)含量和叶片相对电导率(EC)较低。同一土壤压实处理下,接种AMF处理的脯氨酸含量降低,可溶性糖、可溶性蛋白含量增加。接种处理能有效地增强高羊茅的抗土壤压实能力,以混合接种处理最优。
The effect of arbuscular mycorrhizal fungi (AMF) on the growth and physiology of Festuca arundinacea was studied under different soil compaction stresses. The results showed that under four different types of soil compaction stress, inoculation of AMF in F. arundinacea led to higher superoxide dismutase (SOD) activity, peroxidase (POD) activity, catalase (CAT) activity, and nitrate reductase (NR) activity than that of the non-inoculated treatment, whereas malondialdehyde (MDA) content and leaf relative conductivity (EC) decreased. Soluble sugar and protein content increased with the inoculation of AMF under the same soil compaction stress, whereas proline content decreased. Inoculated treatment with AMF significantly increased the stress resistance of F. arundinacea ( P<0.05), and the mixed inoculated treatment was the best.
土壤压实是城市土壤物理退化的主要形式和普遍存在的现象[1], 压实导致土壤结构体破坏、容重增加、孔隙度降低、渗水率下降[2]、穿透阻力增大, 影响植物生理代谢活动。丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是一种专性营养共生真菌[3]。AMF能提高植物的抗旱性、抗病性[4]、耐盐性[5]、耐低温[6]、耐金属胁迫[7]等, 但关于AMF对城市压实土壤环境下植物生理的研究报道甚少。
本研究采用PVC管为容器, 人为夯实对土壤进行压实, 模拟土壤压实胁迫下接种丛枝菌根真菌对高羊茅(Festuca arundinacea)抗逆性生理调节物质含量作比较研究, 从而阐明接种丛枝菌根真菌对高羊茅适应土壤压实胁迫的生理机制, 为菌根技术在压实土壤绿化中的应用提供理论依据和技术基础。
供试菌种:摩西管柄囊霉(Funneliformis mosseae, Fm)和根内球囊霉(Glomus intraradice, Gi)两种菌种均来自青岛农业大学菌根生物技术研究所, 采用三叶草(Trifolum)扩繁, 接种剂含AMF孢子、菌丝片段、侵染根段。
供试植物:高羊茅“ 艾瑞3号” , 英文名Arid Ⅲ 。
供试土壤为棕壤, 采自青岛农业大学, 基本性状为:pH 6.91, 速效磷含量11.73 mg· kg-1, 速效钾含量184.27 mg· kg-1, 全氮含量85.09 mg· kg-1, 全磷含量2.27 g· kg-1, 全钾含量497.07 mg· kg-1, 有机质含量1.84%, 灭菌(121 ℃, 2 h)。
土壤处理:试验于2016年3月在青岛农业大学日光温室进行。土壤压实梯度参照青岛市城阳区土壤压实现状[8], 设4个压实梯度, 分别为1.2、1.3、1.4和1.5 g· cm-3; 每个压实梯度分别接种摩西管柄囊霉、根内球囊霉、摩西管柄囊霉和根内球囊霉混合菌剂5 000接种势[IP=N× W× K+S, IP为接种势单位, N为单位长度根段内含有的泡囊数量, W为根重(g), K为单位质量根系长度(cm), S为单位质量或体积接种剂内孢子数量][9], 对照(CK)加等量灭菌接种物。即AMF(4)× 压实梯度(4)共16个处理, 每个处理有6次重复, 随机排列。容器选用PVC管, 管内径10 cm, 高23 cm。根据土壤紧实度要求、容器体积及土壤含水量计算出每个处理所需的土壤重量, 然后装土, 容重大的采用木夯锤击压实。每个处理土壤装至离管边3 cm处。每个PVC管内播种50粒高羊茅种子[10], 保持土壤含水量为20%~30%。同年5月26月采样测定。
抗氧化酶活性:超氧化物歧化物(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)、硝酸还原酶(nitrate reductase, NR)活性均参考王学奎[11]的方法测定。抗坏血酸过氧化物酶(ascorbate peroxidase, APX)按照陈建勋和王晓峰[12]的方法进行测定。
渗透调节物质:脯氨酸、可溶性糖、可溶性蛋白含量均参考王学奎[11]的方法测定。
质膜系统:相对电导率(EC)、丙二醛(malondialdehyde, MDA)含量均参考王学奎[11]的方法测定。
采用Microsoft Excel 2003软件进行数据统计、绘图, 用DPS 7.05软件进行多重比较分析(LSD法)。
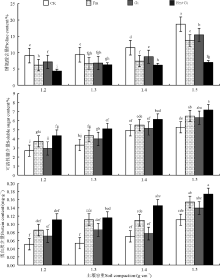
在一定范围内, 随着土壤容重的增加高羊茅叶片中的SOD、POD、APX值会有所增加, 而CAT值则下降, NR则先升高后下降(表1)。接种AMF处理, 高羊茅叶片的SOD、POD、CAT、APX、NR活性均显著提高; 同一种土壤压实胁迫下, 混合接种处理极显著优于未接种处理, 其次是摩西管柄囊霉, CK处理最差。并且在1.3 g· cm-3的土壤容重和混合接种方式下这3种酶活性最强, SOD为708.67 U· g-1、POD为63.93 U· (min· g)-1、CAT为52.20 U· (min· g)-1、APX为1 031.40 U· (min· g)-1、NR为8.16 U· (min· g)-1。土壤压实胁迫和AMF交互作用对高羊茅叶片SOD、APX、NR活性的影响达到显著水平(P< 0.05), 但对POD、CAT活性没有显著影响(P> 0.05)。
| 表1 AMF和土壤压实胁迫对高羊茅SOD、POD、CAT、APX、NR活性的影响 Table 1 Effect of arbuscular mycorrhizal fungi and soil compaction on superoxide dismutase activity, peroxidase activity, catalase activity, ascorbate peroxidase, and nitrate reductase activity in Festuca arundinacea |
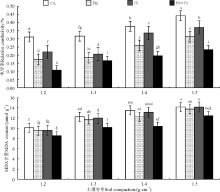
在一定范围内, 土壤容重的增加使未接种处理的高羊茅叶片可溶性糖、蛋白质含量和脯氨酸含量显著升高(P< 0.05)(图1)。接种处理后显著(P< 0.05)提高高羊茅叶片可溶性糖、蛋白质含量及降低脯氨酸含量。在1.5 g· cm-3的土壤容重下混合接种显著(P< 0.05)提高了高羊茅的可溶性糖含量和蛋白质含量, 与未接种处理相比, 分别增加了36.03%、56.69%; 而脯氨酸的含量则降低了62.42%。方差分析表明, 土壤压实胁迫和AMF对高羊茅脯氨酸含量影响极显著(P< 0.01), 对蛋白质含量影响显著(P< 0.05), 而对可溶性糖含量没有显著性影响(P> 0.05)。
随着土壤压实胁迫程度增大, 高羊茅丙二醛的含量和相对电导率呈上升趋势(图2), 在同一菌种作用下, 丙二醛的含量随土壤容重的增大而增加, 容重为1.5 g· cm-3的处理胁迫下丙二醛的含量和相对电导率与容重为1.2 g· cm-3的处理差异显著(P< 0.05), 接种AMF降低了土壤压实胁迫下高羊茅丙二醛的含量和相对电导率。方差分析表明, 土壤压实胁迫和AMF对高羊茅相对电导率影响显著(P< 0.05), 而对MDA含量影响不显著(P> 0.05)。
新陈代谢过程中或受到外界环境胁迫时, 植物体内会产生过多的活性氧, 这些多余的活性氧会对植物生长产生严重的毒害, 如植物细胞膜系统被破坏、抗氧化酶失活、信号传递受阻等[13, 14]。吴亚维等[15]研究认为紧实土壤中生姜(Zingiber officinale)生长较弱, 易遭受土壤紧实胁迫, 导致生姜保护酶活性增强。可能是因为植物体内抗氧化酶合成受细胞内底物水平的控制, 土壤压实条件下, 植株体内H2O2含量显著增加[16], 为清除高羊茅体内过氧化物, 抗氧化酶活性提高[14]。当植物体内产生并积累的过氧化物超出防御系统的清除能力会引起活性氧的积累, 造成膜脂过氧化和膜系统的损坏, 丙二醛及相对导率升高, 严重时会致使植物细胞死亡[17]。本研究发现, 随着土壤容重的增加高羊茅叶片中SOD、POD及APX活性升高, 但CAT活性有所下降, 且叶片中丙二醛及相对电导率升高, 表明高羊茅在压实胁迫下, 植物体内产生了过多的氧化物, 并对高羊茅产生了一定的毒害。接种AMF处理的土壤压实下高羊茅抗氧化酶活性有显著影响, 土壤压实胁迫下接种都显著提高了高羊茅叶片的SOD、POD、CAT、APX, 并降低了相对电导率和丙二醛含量。该结果与接种AMF提高植物抗盐性[18, 19]、抗旱性[20]、耐低温[21]等逆境表现一致, 这表明接种AMF能有效提高土壤压实胁迫下植物抗氧化酶活性, 减轻土壤压实胁迫对植物生长的伤害。可能是植物对外源微生物侵入的应激反应, 虽然AMF与植物是互惠共生体系, 当接种AMF后, 大量的外源真菌侵染根系, 导致抗氧化酶活性增加[22]。
土壤压实后会使其容重增加、渗透率下降、蓄水力下降、有效水含量下降, 不利于植物生长。当植物生长受到抑制, 会通过降低细胞的渗透势来适应外界环境, 这一现象称作渗透调节[23]。渗透物质分为两种, 一种是无机渗透调节离子, 如K+、Mg2+等; 另一种是有机渗透调节物质, 如脯氨酸、可溶性糖、游离氨基酸、甜菜碱等。刘爽和吴永波[24]认为土壤压实会增大树木脯氨酸含量。Pedrol等[25]研究认为, 植物受到胁迫时, 游离脯氨酸和可溶性蛋白同时增加。张显强等[26]认为, 胁迫进一步加强则会使可溶性糖积累, 植物通过渗透调节物质的积累, 减少渗透势, 保护细胞内酶类活动, 维持了细胞的正常功能[27]。本研究中, 随着土壤容重的增加, 高羊茅叶片的脯氨酸含量、可溶性糖、可溶性蛋白含量呈显著增加。接种AMF处理的高羊茅叶片中可溶性糖含量极显著增加, 蛋白质含量显著增加而脯氨酸含量极显著降低。脯氨酸含量能反映植物受胁迫的强弱。贺学礼等[28]认为干旱胁迫下接种AMF降低了民勤绢蒿(Seriphidium minchunense)叶片脯氨酸含量。柏晓玲等[21]认为AMF提高盐胁迫下黄瓜(Cucumis sativus)幼苗可溶性蛋白、可溶性糖等渗透调节物质含量, 提高植物抗盐性。表明接种AMF能缓解水分胁迫对植物生长的影响。本研究中, 土壤压实胁迫下高羊茅渗透物质含量显著增加, 接种AMF处理高羊茅叶片可溶性糖、蛋白质含量升高脯氨酸含量显著下降。这与柳洁等[29]研究结果一致, 表明接种AMF能提高植物抗压实胁迫性。
硝酸还原酶(NR)是植物体内控制硝酸盐同化的关键酶, 硝酸还原酶活性高低控制着这一同化过程, 同时影响植物体内蛋白质的合成[30]。斯琴巴特尔和吴红英[31]研究认为干旱、盐和盐碱逆境下玉米(Zea mays)幼苗叶片硝酸还原酶活性显著下降。陈丹明等[32]认为接种AMF有利于提高牡丹(Paeonia suffruticosa)幼苗的叶绿素含量、硝酸还原酶、可溶性糖及可溶性蛋白的含量, 增强牡丹幼苗生理活性和抗逆性。本研究中硝酸还原酶活性受到土壤压实的影响, 随着土壤容重的增大, 高羊茅叶片中硝酸还原酶活性降低而接种AMF处理的硝酸还原酶活性显著高于未接种处理。
接种AMF增强高羊茅叶片渗透调节物质和抗氧化酶活性降低氧化胁迫造成的伤害。本研究结果显示, AMF与土壤容重的交互作用可极显著或显著影响高羊茅叶片SOD、APX、NR、蛋白质含量、相对电导率, 说明接种AMF尤其是混合接种处理能在一定程度上改善高羊茅的抗压实能力, 而AMF与土壤容重的交互作用仍需要进一步深入研究。本研究探索和揭示AMF通过介导植物生理生化代谢途径来提高高羊茅抗土壤压实胁迫, 对AMF在压实土壤中的应用有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|