第一作者:杜超(1990-),男,内蒙古锡林郭勒人,在读博士生,主要从事植物抗逆分子生物学研究。E-mail:[email protected]
MYB转录因子家族在植物抵抗非生物胁迫过程中发挥着重要的调控作用。基于转录组测序数据,从珍稀泌盐盐生植物长叶红砂( Reaumuria trigyna)中克隆一个MYB转录因子基因,命名为 RtMYB1。 RtMYB1基因具有780 bp的ORF(open reading frame)序列,编码236个氨基酸残基组成的蛋白。 RtMYB1能够被盐、冷、高温、紫外照射(UV)和干旱(PEG)5种非生物胁迫诱导表达,这表明 RtMYB1基因可能参与长叶红砂响应非生物胁迫的调节途径。本研究为深入了解长叶红砂的抗逆机理及发掘优异的抗逆基因奠定了基础。
The MYB transcription factor family plays an important regulatory role in imparting resistance to abiotic stress in plants. Based on transcriptome sequencing data, an MYB transcription factor was cloned from a rare secretohalophyte, Reaumuria trigyna, and named RtMYB1. The RtMYB1 gene has an ORF of 780 bp, encoding 236 amino acid residues. Expression of the RtMYB1 gene can be induced by stress factors, including salt, cold, high temperature, ultraviolet radiation(UV), and drought (PEG), indicating that the gene may be involved in regulating the response of R. trigyna to abiotic stress. This study lays the foundations to explore and better understand the resistance mechanisms against abiotic stress in R. trigyna.
非生物胁迫如极端温度、盐渍、干旱和化学污染等经常影响植物的正常生长发育, 导致作物产量降低, 品质下降[1]。植物经过长期进化, 逐渐形成了多种复杂机制以应对各种逆境胁迫[2, 3, 4, 5]。转录因子通过调控体内抗逆相关功能基因的表达, 引发多重抗逆相关生理生化反应, 最终减少、消除逆境造成的危害[6, 7, 8, 9]。多项研究发现, HSF[10]、CBF/DREB[11, 12]、ABF/ABAE[13]、WRKY[14]、MYB[15]、WOX[16]等转录因子家族具有调控植物生长发育、次级代谢和响应逆境胁迫的功能。
植物中的MYB蛋白家族成员均含一个高度保守的DNA-结合结构域, 即MYB结构域。这个结构域由MYB转录因子N端的含有约52个氨基酸构成的1~4个串联的、不完全重复序列组成, 通过折叠成螺旋-转角-螺旋(Helix-Turn-Helix, HTH)的形式参与与DNA大沟的结合[17, 18]。Clorless1(C1)基因是最早从玉米(Zea mays)中被克隆的植物类MYB转录因子[19], 随后, 更多的MYB转录因子从金鱼草(Antirrhinum majus)[20]、拟南芥(Arabidopsis thaliana)[21]、茄子(Solanum melongena)[22]、淫羊藿(Epimedium sagittatum)[23]等植物中分离和鉴定出来。MYB转录因子在植物调控激素应答、次级代谢以及响应各种生物胁迫、非生物胁迫等生理活动中都扮演重要的角色。MYB转录因子可以通过调控激素应答从而提高植物抗逆性, 例如, 在干旱条件下, 拟南芥中的MYB转录因子AtMYB2和AtMYB37被诱导表达, 通过调控脱落酸(ABA)的含量或增加对ABA的敏感性, 提高了植株的抗逆性[24, 25]; MYB转录因子可以调控植物的次级代谢从而提高植物抗逆性, 如将毛白杨(Populus tomentosa)PtoMYB170基因转化拟南芥, 结果显示, 转基因植株中木质素含量增加, 黑暗中气孔闭合增强, 水分流失降低, 最终提高了植株的抗旱能力[26]; 此外, MYB转录因子也可通过信号转导途径调控其体内相关基因的表达来响应逆境胁迫, 如小麦(Triticum aestivum)中TaSIM编码的R2R3-MYB转录因子可以被干旱、高盐、低温和ABA处理诱导, 将该基因转化拟南芥, 转基因植株中ABA依赖型(RD22)和ABA非依赖型(RD29A)的逆境应答基因均上调表达, 进而提高其耐盐性[27]。
长叶红砂(Reaumuria trigyna), 又名黄花红砂、黄花琵琶柴, 属于柽柳科(Tamaricaceae), 琵琶柴属, 为古地中海孑遗植物, 是亚洲中部东阿拉善-西鄂尔多斯地区特有珍稀泌盐植物[28, 29, 30], 被称为“ 活化石” , 是内蒙古自治区的重点保护植物[31]。东阿拉善-西鄂尔多斯地区为典型的戈壁荒漠区, 具有高盐、干旱和严寒等环境特点[32, 33]。长叶红砂因特有的劈裂生长、圆柱形肉质化叶片、活力高耐储存的种子等形态结构及生理特征, 具有极强的生境适应性, 常被作为盐碱地改良和防风固沙的先锋植物[34, 35]。2013年Dang等[32]利用Illumina测序技术对长叶红砂植株进行了转录组深度测序, 结果显示, 离子转运相关基因、活性氧清除系统基因和转录因子在盐胁迫前后表达量发生了显著变化, 表明长叶红砂具有高效的离子平衡机制和抗氧化系统, 转录因子可能在长叶红砂响应盐胁迫的过程中发挥了积极的调控作用。Du等[36]的研究证实, 长叶红砂RtWRKY1的过量表达可以提高转基因拟南芥的耐盐性。MYB作为另一大类抗逆相关转录因子, 极有可能参与长叶红砂逆境应答过程。然而, 目前关于MYB转录因子的研究多集中在拟南芥、棉花(Anemone vitifolia)、番茄(Lycopersicon esculentum)、水稻(Oryza sativa)等模式植物或农作物中, 野生抗逆植物的相关报道并不多见。基于长叶红砂盐胁迫转录组数据, 本研究选取一个注释为MYB转录因子且在盐处理后表达显著上调的Unigene, 将其命名为RtMYB1, 对该基因进行生物信息学和表达模式分析, 将有助于进一步探索该基因的调控作用, 以及深入理解长叶红砂的抗逆机理。
长叶红砂种子于2015年10月采自内蒙古乌海市青年桥, 经晒干后室温贮藏备用。
植物总RNA提取试剂盒RNA Plant Plus购自北京天根生化科技有限公司; 第一链合成试剂盒PrimeScriptTM II 1st Strand cDNA synthesis kit、PrimeScriptTM RT Master Mix购自TaKaRa公司。引物合成及常规测序由北京六合华大基因科技股份有限公司完成。
1.2.1 长叶红砂幼苗培养及胁迫处理 挑选饱满长叶红砂种子, 10% NaClO浸泡10~15 min, 灭菌ddH2O清洗3~5次, 播种于含有40 mL MS培养基的三角瓶中, 暗培养3 d后, 在25 ℃、相对湿度70%, 光周期为16 h光照/8 h黑暗条件下生长。待幼苗高约10 cm时, 转移至内含50 mL 1/2 Hoagland营养液的大试管中培养, 间隔3 d更换一次营养液。
在大试管中继续培养1个月, 选取长势一致的幼苗, 分别用30% PEG-6000、紫外照射(UV)、4 ℃及42 ℃、不同浓度 NaCl(200、400、600 mmol· L-1)处理0、3、6、12和24 h, 采集叶片后经液氮速冻, 贮存于-80 ℃超低温冰箱中。
1.2.2 RNA的提取及cDNA的合成 长叶红砂总RNA的提取参照天根RNA Plant Plus植物总RNA提取试剂盒说明书进行。采用DNase I(RNase-free)消化RNA样本中的残余DNA, 分别用NanoVue Plus微量紫外分光光度计和1%琼脂糖凝胶电泳检测总RNA的浓度和完整性。
基因克隆所需的cDNA合成参照TaKaRa公司的PrimeScriptTM Ⅱ 1st Strand cDNA synthesis kit试剂盒说明书进行。PCR反应总体系20 μ L, 首先在PCR管依次加入1 μ L Random 6 mers, 1 μ L dNTP Mixture, 1 μ L长叶红砂RNA, 7 μ L RNase free dH2O, 65 ℃反应5 min后冰上迅速冷却; 随后继续加入4 μ L 5× PrimeScript Ⅱ Buffer, 0.5 μ L RNase Inhibitor, 1 μ L PrimeScript Ⅱ RTase, 4.5 μ L RNase free ddH2O, 缓慢摇匀, 30 ℃孵育10 min, 42 ℃反应 60 min, 95 ℃保温5 min; 最后冰浴冷却获得长叶红砂cDNA。
荧光定量PCR(Real Time quantitative PCR, qPCR)所需的cDNA合成参照TaKaRa公司的PrimeScriptTM RT Master Mix试剂盒说明书进行。反应体系为5× Mix 2 μ L, Total RNA 100 ng, 最后加入ddH2O至10 μ L。反应程序为37 ℃下运行15 min, 之后85 ℃运行5 s, 在4 ℃下保存备用。
1.2.3 RtMYB1基因的克隆 根据长叶红砂高通量测序结果中功能注释为MYB转录因子(Unigene 21094)的Unigene序列设计引物(表1), 以长叶红砂cDNA为模板, 克隆获得Unigene 21094的ORF序列。PCR反应体系为25 μ L, 包含2.5 μ L 10× TransStart Taq buffer、0.2 mmol· L-1 dNTPs、0.4 μ mol· L-1上下引物、1 μ L TransStart Taq DNA Polymerase、1 μ L cDNA。PCR反应程序为94 ℃预变性5 min, 94 ℃变性30 s、58 ℃复性30 s、72 ℃延伸 30 s, 30个循环, 最后72 ℃再延伸5 min。PCR产物经切胶回收, 转化大肠杆菌DH5α 感受态细胞, 酶切鉴定后进行双向测序。
| 表1 引物序列 Table 1 Primer sequences |
1.2.4 RtMYB1基因的生物信息学分析 利用NCBI的ORF Finder识别开放阅读框并翻译出氨基酸序列; 利用DNAMAN 6.0软件分析蛋白的理论分子量和等电点; 利用SOPMA和SWISS-MODEL软件预测蛋白二、三级结构; 蛋白序列比对用Clustal W软件执行; 系统进化树用MEGA 5.0软件, 邻接法(neighborjoining, N-J)绘制系统进化树。
1.2.5 RtMYB1基因的表达模式分析 以cDNA作为模板进行qPCR, 用β -Actin作为内参基因(表1)。参照Transgen公司的TransStartRTip Tip Green qPCR SuperMix试剂盒说明书进行。qPCR反应参照体系为20 μ L PCR, 内含2× TransStartRTip Tip Green qPCR SuperMix 10 μ L, 引物各0.4 μ L, cDNA模板1 μ L。PCR反应程序为95 ℃预变性5 min, 94 ℃变性30 s、54~57 ℃退火30 s、72 ℃延伸30 s, 35个循环, 72 ℃延伸10 min。
利用SPSS软件进行数据处理。
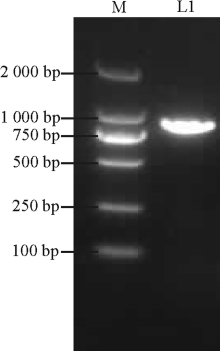
根据长叶红砂高通量测序结果中功能注释为MYB转录因子(Unigene 21094)的序列设计引物, 克隆获得了780 bp的ORF序列(图1), 编码236个氨基酸。该基因是第1个被发现的长叶红砂MYB基因, 因此命名为RtMYB1。
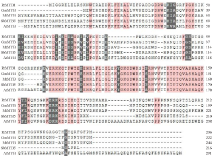
氨基酸序列分析显示, RtMYB1基因编码的蛋白具有典型的高度保守的DNA-结合结构域, 即MYB结构域, 属于MYB转录因子家族(图2)。RtMYB1蛋白相对分子量26.26 KDa, 等电点为8.75。氨基酸比对分析表明, 同源性最高的为大豆(Glycine max, ALA09221.1)和蒺藜苜蓿(Medicago truncatula, KEH44287.1), 同源性为94%; 其次为黄芩(Scutellaria baicalensis, AGZ16405.1), 同源性为83%; 最低的为拟南芥(Arabidopsis thaliana, AAC27179.1), 同源性为74%(图2)。
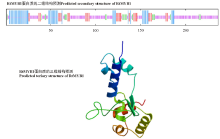
蛋白质二、三级结构预测显示, RtMYB1蛋白的236个氨基酸中, 50个是α 螺旋(蓝色), 占21.19%; 39个是延伸链(红色), 占16.53%; 21个是β 转角(绿色), 占8.9%; 126个是随机卷曲(紫色), 占53.39%(图3)。系统进化树分析显示, 长叶红砂RtMYB1转录因子与黄芩、蓖麻(Ricinus communis)、麻风树(Jatropha curcas)的亲缘关系较近, 与无刺枣(Ziziphus jujuba)、苹果(Malus domestica)的亲缘关系次之, 与绿豆(Vigna radiata)、野生大豆、木豆(Cajanus cajan)的亲缘关系较远(图4)。
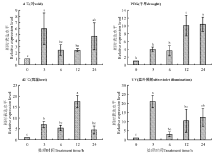
植物基因在受到不同的生物及非生物胁迫时会诱导发生不同的生理代谢功能以抵御胁迫, 所以基因的表达模式也不同。为了了解RtMYB1基因在不同非生物胁迫下的表达模式, 利用qPCR对RtMYB1基因在不同非生物胁迫下的表达情况进行了分析。结果显示, 该基因在不同梯度盐胁迫处理时, 相较对照均表现出表达量上升的趋势, 且在胁迫3 h时达到峰值(图5); 在其他胁迫条件下, 冷(4 ℃)和UV处理表达模式较为接近, 3 h处理时基因表达量最高, 然后下降, 在胁迫晚期(12-24 h)表达量又呈现出上升的情况; 高温(42 ℃)胁迫处理6 h后出现表达量的高峰; 而干旱胁迫(PEG)处理后, RtMYB1基因的表达量随胁迫时间的延长整体趋势呈现持续上升的状态(图6)。研究结果表明RtMYB1基因的表达受盐(NaCl)、冷(4 ℃)、高温(42 ℃)、UV和干旱(PEG)5种非生物胁迫的诱导, 且不同处理间RtMYB1基因的表达量存在差异, 因此推测, RtMYB1转录因子在长叶红砂响应非生物胁迫过程中可能起到了积极调控作用。
 | 图5 RtMYB1基因在盐胁迫下的表达量变化Fig. 5 Changes in expression levels of RtMYB1 gene under salt-based abiotic stress |
MYB转录因子是植物抵抗非生物胁迫过程中起重要作用的一类调控因子, 可以通过调控植物的生长发育、次级代谢、植物激素介导的防御信号转导等生理过程来提高植物的耐受性[37]。本研究基于长叶红砂转录组数据, 从长叶红砂中分离获得RtMYB1基因, 氨基酸序列分析显示这个基因具有典型的MYB结构域。系统进化树分析显示, RtMYB1蛋白与野生植物黄芩、蓖麻和麻风树的亲缘关系较近, 而与农作物苹果和绿豆的亲缘关系较远(图 4)。因此, 相较于农作物的MYB转录因子, RtMYB1蛋白的生物学功能可能与野生植物的MYB转录因子功能更相似。
作为植物响应逆境胁迫过程中重要的转录因子, MYB转录因子能够快速被多种逆境胁迫诱导表达, 从而及时发挥其调控作用, 使得植物能够迅速适应逆境。已有的研究发现, 大豆GmMYB76、GmMYB92和GmMYB177可以被盐、冷和干旱这些非生物胁迫诱导表达, 但是 ABA 处理表达量无明显变化[38]。水稻OsMYB2则在盐、冷和干旱胁迫以及ABA 处理下均可被诱导表达[39]。此外, Ding等[40]发现拟南芥中AtMYB15超表达植株具有更抗干旱、抗盐的特性且对ABA超敏感。长叶红砂RtMYB1转录因子在盐(NaCl)、冷(4 ℃)、高温(42 ℃)、UV和干旱(PEG)5种非生物胁迫下均被诱导表达, 这些胁迫条件与长叶红砂高盐、干旱、冬季严寒、夏季酷热、日照强烈的生境吻合, 结果显示RtWRKY1的表达在该植物适应严酷生境发表发挥着作用。值得注意的是, 该基因快速响应盐、冷和UV(3 h)胁迫, 较晚响应干旱胁迫(12、24 h)和高温胁迫(12 h), 表明RtMYB1基因可能通过不同机制参与长叶红砂响应非生物胁迫的调节途径, 需要进一步的研究证实。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|