第一作者:林选栋(1992-),男,甘肃岷县人,在读硕士生,主要从事饲草料资源与生态修复的研究。E-mail:[email protected]
采用盆栽试验研究了高羊茅( Festuca arundinacea)幼苗在不同盐浓度胁迫下生物量、抗氧化酶活性和渗透调节物质对硅的响应。结果显示,随盐浓度增加高羊茅生物量逐渐降低,而盐浓度小于50 mmol·L-1或大于250 mmol·L-1时,硅对高羊茅生物量没有明显影响,盐浓度介于50到250 mmol·L-1,硅显著提高了高羊茅生物量( P<0.05)。随着盐浓度增加过氧化氢酶(CAT)活性呈上升趋势,过氧化物酶(POD)和超氧化物歧化酶(SOD)活性先上升后下降,添加硅虽然提高了POD、SOD和CAT活性,但不同酶显著增加时盐浓度存在一定的差异。可溶性糖和可溶性蛋白含量随着盐浓度的增加呈先上升后下降的趋势,丙二醛含量呈上升趋势,盐浓度为200和250 mmol·L-1时,可溶性糖和可溶性蛋白含量达到峰值,添加硅均降低了高羊茅体内可溶性糖、可溶性蛋白和丙二醛含量。上述结果表明,硅对高羊茅适应盐胁迫能力的影响在盐浓度间存在分异,过低或过高盐浓度时,硅对高羊茅适应性没有显著影响,中盐浓度时,硅能通过增强高羊茅体内的抗氧化酶活性、改善渗透调节过程和降低膜质氧化来增强其对盐胁迫的适应性。
In this study, a pot experiment was conducted to determine the response of biomass, antioxidant enzyme activities, and osmotic regulators to silicon in tall fescue seedlings under different salt stress condition. The results showed that with an increase in salt concentration, the biomass of tall fescue decreased gradually. When the salt concentration was less than 50 mmol·L-1 or greater than 250 mmol·L-1, silicon had no obvious effect on the biomass of tall fescue; when the salt concentration was between 50 and 250 mmol·L-1, the biomass of tall fescue increased significantly ( P<0.05) with silicon. With an increase in salt concentration, CAT activity increased, and POD and SOD first increased and then decreased. Although the addition of silicon increased the activity of POD, SOD, and CAT, there are some differences in the salt concentrations when the different enzymes increased significantly. With an increase in salt concentration, MDA content increased, soluble sugar and soluble protein content first increased and then decreased, and when the salt concentration reached 200 and 250 mmol·L-1, soluble sugar and soluble protein contents reached their highest values. The addition of silicon reduced the contents of soluble sugar, soluble protein, and MDA in tall fescue. The above results showed that the effect of silicon on the salt tolerance of tall fescue varied under different salt stresses. When the salt concentration was too low or too high, the silicon had no significant effect on the adaptability of tall fescue, but when the salt concentration was in a middle range, the silicon enhanced the adaptability to salt stress of tall fescue by increasing the antioxidant enzyme activity in the plants, improving the osmotic adjustment process and reducing membrane oxidation.
高羊茅(Festuca arundinacea)具有较好的耐践踏、耐热、耐干旱以及耐盐等特性, 且适口性佳、营养价值高, 是倍受人们重视的牧草和草坪草, 被广泛种植于我国北方地区[1, 2]。但是, 由于近年来我国生态环境不断恶化, 各类盐渍土壤不断增加, 往往使其生长于盐胁迫的环境中[3], 影响其生长发育。植物在遭受轻度盐胁迫时会通过调节自身的形态特征和生理生化过程来适应[4], 而重度盐胁迫会引起植物体内自由基的大量积累、膜质氧化作用增强、细胞膜通透性增大等, 导致植物枯萎甚至死亡[5]。因此, 提高高羊茅在盐胁迫环境中的适应能力, 已成为我国北方地区高羊茅栽培草地健康生长的重要途径。
硅在土壤中以单硅酸的形式被植物根系吸收及转移, 最终主要以“ 生物起源蛋白石” 的形式沉积在植物体中, 有利于植物的生长发育[6], 且其有利效应在非生物胁迫下更为明显[7]。研究表明, 添加硅能够提高大麦(Hordeum vulgare)[8]、番茄(Lycopersicon esculentum)[9]和水稻(Oryza sativa)[10]等植物在盐胁迫下的耐盐性, 其原因是添加环境友好型元素硅提高了植株抗氧化酶的活性, 增强了植物体内清除· O2-的能力, 降低了膜脂过氧化作用对细胞膜的伤害[9, 11]。目前, 已有研究表明添加外源硅能够提高盐生境下高羊茅的发芽率和出苗率[12, 13] , 然而, 盐生境指高羊茅从播种开始就一直生存于盐生环境中, 高羊茅适应盐生境的时间相对比较长, 但盐胁迫则是生长良好的高羊茅突然遭受盐分伤害, 那么硅促进盐生境下高羊茅的生长特性理论是否能够被用于指导盐胁迫下高羊茅草地的管理, 尚需科学佐证。因此, 本研究采用盆栽试验, 通过研究不同盐胁迫下硅对高羊茅生物量、抗氧化能力和渗透调节物质的影响, 以期阐明硅对高羊茅遭受盐胁迫时的产量特征和生理特征应答, 从而为我国北方地区高羊茅草地的生产和管理提供技术支持。
本研究采用盆栽试验, 所用的种子来源于北京百绿集团, 分别用盐浓度和加硅与否, 进行二因素处理。盐浓度分别设置为0、50、100、150、200、250、300 mmol· L-1, 每个盐浓度下设置添加硅(+Si)和不添加硅(-Si)两个处理, 整个试验共14个处理, 每处理重复8次。试验在兰州大学日光智能温室内进行, 采用高15 cm、盆口直径20 cm的塑料盆, 每个花盆内播种饱满的高羊茅种子300粒, 基质为珍珠岩和蛭石(体积比为1:1)的混合物, 硅源采用2 mmol· L-1硅酸钠[14]。盐采用氯化钠, 计算盐分浓度时包括硅酸钠内的钠离子。根据试验设计, 播种开始后先用Hoagland营养液进行培养, 待高羊茅生长至6 cm时, 在Hoagland营养液中添加相应的硅酸钠和氯化钠, 实现盐胁迫处理, 处理采用隔天浇灌, 浇灌量以塑料盆下面的小孔有液体流出为止。为了避免盐激作用对高羊茅植株的影响, 盐溶液浓度≤ 100 mmol· L-1的处理中, 其浓度每次递增25 mmol· L-1, 盐溶液浓度> 100 mmol· L-1的处理中, 浓度每次递增50 mmol· L-1, 直至达到最终设计的盐浓度后, 继续浇灌14 d, 取样进行设定指标检测。
生物量的测定采用常规烘干法[15]。可溶性蛋白的测定采用考马斯亮蓝法, 丙二醛的测定采用硫代巴比妥酸法[16]。参照愈创木酚法[17]测定过氧化物酶(POD)。用蒽酮比色法测定可溶性糖, NBT法测定超氧化物歧化酶(SOD)活性, 硫代巴比妥酸滴定法测定过氧化氢酶(CAT)活性[15]。
数据分析采用SPSS 19.0进行二因素方差分析, 采用Excel 2010软件绘制图表。
单因素盐浓度和硅均显著影响了高羊茅幼苗的生物量(P< 0.05), 但二者互作对高羊茅幼苗生物量影响不显著(图 1)。当盐浓度≤ 50 mmol· L-1时, 硅和盐浓度对高羊茅生物量没有显著影响(P> 0.05); 当盐浓度为100~200 mmol· L-1时, 随着盐浓度增加无论加硅与不加硅高羊茅生物量都呈显著下降趋势(P< 0.05), 但是相同盐浓度下加硅处理高羊茅生物量显著高于不加硅处理(P< 0.05)。硅对高羊茅生物的增幅量呈先上升后下降的趋势, 盐浓度为100 mmol· L-1时, 加硅增幅最小, 增幅为10.98%, 盐浓度为200 mmol· L-1加硅增幅最大, 增幅为21.20%; 盐浓度≥ 200 mmol· L-1时, 添加硅对高羊茅生物量影响不显著。
硅与盐浓度均显著影响了高羊茅幼苗SOD、POD、CAT活性(P< 0.05), 硅与盐浓度互作对其影响不显著(图 2)。无论加硅与不加硅, SOD和POD活性均随着盐浓度的增加呈现先上升后下降的趋势, CAT活性呈现上升趋势, 但不同抗氧化酶活性显著增减所对应的盐浓度存在分异。不添加硅时, SOD和POD活性在盐浓度为200 mmol· L-1时增加到峰值, 此后SOD活性显著降低(P< 0.05), POD活性有下降趋势但不显著, 当盐浓度为300 mmol· L-1时SOD活性低于对照, 该盐浓度下CAT活性上升达显著水平(P< 0.05); 添加硅时, POD活性呈显著先上升趋势(P< 0.05), 当盐浓度为200 mmol· L-1时增加到峰值, 此后开始下降但不显著; 随着盐浓度的增加SOD活性呈先上升后下降趋势, 盐浓度为150 mmol· L-1时增加到峰值; CAT活性在盐浓度≥ 200 mmol· L-1时显著增加(P< 0.05), 其他浓度下没有显著变化。
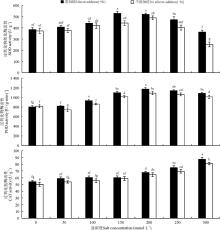 | 图2 不同盐胁迫水平下硅对高羊茅幼苗抗氧化酶的影响Fig. 2 Effect of silicon supplies on antioxidase of tall fescue seedlings under different salt concentrations |
硅对高羊茅幼苗抗氧化酶活性的影响与盐浓度高低密切相关, 当盐浓度为150、250、300 mmol· L-1时硅显著提高了SOD活性(P< 0.05), 盐浓度为300 mmol· L-1时增幅最大, 与该盐浓度下不加硅相比提高了44.41%; 相同浓度下硅显著提高了高羊茅POD活性(P< 0.05), 在盐浓度为50 mmol· L-1时增幅最多, 与该浓度下不加硅相比增幅为10.60%; 当盐浓度为300 mmol· L-1时硅显著提高了高羊茅CAT活性(P< 0.05)。
硅与盐浓度均显著影响了高羊茅幼苗可溶性糖和可溶性蛋白含量(P< 0.05), 硅与盐浓度互作对其影响不显著(图3)。不添加硅时, 高羊茅幼苗可溶性糖和可溶性蛋白含量均随着盐浓度的增加呈先增加后降低变化趋势, 但是二者峰值所对应的盐浓度存在差异, 盐浓度为200 mmol· L-1时, 高羊茅体内可溶性糖含量最多, 与对照相比增加了16.54%, 而可溶性蛋白含量最高时的盐浓度为250 mmol· L-1, 较对照增加了45.94%, 在150、200 mmol· L-1时可溶性糖含量显著增加(P< 0.05), 在100、150、200、250、300 mmol· L-1时可溶性蛋白含量显著增加(P< 0.05)。添加硅时, 所有盐浓度条件下高羊茅幼苗体内的可溶性糖和可溶性蛋白含量均显著大于对照(P< 0.05), 但是二者增加的幅度变化趋势不同, 可溶性糖含量呈先上升后下降的趋势, 其中盐浓度为250 mmol· L-1时达到最高, 此时与对照相比增加了15.24%; 可溶性蛋白含量呈逐渐上升最后趋于平缓趋势。
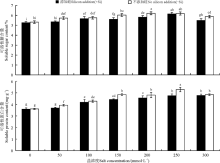 | 图3 不同盐胁迫水平下硅对高羊茅幼苗渗透调节物质的影响Fig. 3 Effect of silicon addition on osmolytes of tall fescue seedlings under different salt concentration conditionss |
硅降低了同一盐浓度下高羊茅幼苗体内可溶性糖和可溶性蛋白含量(P< 0.05), 但降低幅度随盐浓度不同而不同。当盐浓度为50、150、200 mmol· L-1时添加硅显著降低了高羊茅幼苗体内可溶性糖含量(P< 0.05), 盐浓度为150 mmol· L-1时降低最多, 与该浓度下不添加硅相比降低了7.09%; 当盐浓度为50、150、200、250 mmol· L-1时添加硅显著降低了可溶性蛋白含量(P< 0.05), 盐浓度为250 mmol· L-1时降低最多, 与该浓度下不添加硅相比降低了9.86%。
生物量能直接反映植物对盐胁迫环境的适应能力, 是植物耐盐性的重要指标[18, 19]。本研究表明, 在不同盐浓度下高羊茅对硅的响应存在分异, 盐浓度≤ 50 mmol· L-1时, 盐浓度和硅对高羊茅幼苗生物量影响不显著, 说明在该盐浓度范围内盐对高羊茅的伤害不够严重。盐浓度为100~200 mmol· L-1时, 随着盐浓度的增加生物量呈显著下降趋势, 这与对金丝小枣(Zizyphus jujuba)的研究结果趋同[20], 相同盐浓度下硅显著提高了高羊茅幼苗生物量, 这与番茄[9]和水稻[10]等植物对硅的响应一致, 说明该盐浓度已经对高羊茅的生长形成伤害, 但硅可减轻盐胁迫对高羊茅的伤害; 当盐浓度≥ 200 mmol· L-1时, 盐浓度和硅对高羊茅幼苗生物量影响不显著, 说明此时高羊茅受到盐胁迫的伤害较为严重, 超过了高羊茅所能承受的调节范围, 硅的调节能力已经无法修复盐对高羊茅的伤害[21]。硅对胁迫下高羊茅的生物量没有明显的促进作用, 这与宋锐等[12]对不同盐生境下高羊茅的研究结果一致。
生物量的变化是高羊茅适应盐胁迫环境的外在表现, 而高羊茅植株体内抗氧化酶活性、渗透物质含量的增加或减小则是响应盐胁迫环境的内在机制[22, 23]。正常情况下, 植物体内活性氧的产生与清除处于动态平衡, 盐胁迫会使植物体内的活性氧大量积累, 使其平衡被打破, 引起细胞结构和功能受损[24]。一般认为, 植物耐盐性的强弱与自身抗氧化酶活性和渗透调节能力强弱密切相关[25]。在盐胁迫下添加硅不仅改善植物体渗透调节过程, 降低膜质过氧化作用, 缓解盐胁迫对植物造成的伤害, 而且增强了其SOD、POD和CAT的活性, 提高抗氧化酶清除自由基的能力, 使膜结构免受伤害, 从而提高了作物的耐盐性[26, 27], 譬如银杏(Ginkgo biloba)[26] 、黑枸杞(Lycium ruthenicum)[27]和黄瓜(Cucumis sativus)[28]。本研究表明, 高羊茅体内SOD和POD活性随盐浓度增加呈先上升后下降趋势, 而CAT活性整体呈上升趋势, 但盐浓度对抗氧化酶活性的影响存在差异, 其中盐浓度为200 mmol· L-1时, SOD和POD达到峰值, CAT活性也开始显著增加, 这说明盐浓度> 200 mmol· L-1时, 植株体内产生的自由基过多, 超过了SOD、POD、CAT的清除范围, 导致自由基大量积累, 使SOD、POD酶损伤, 从而使SOD、POD活性下降[29], 同时也说明SOD、POD和CAT在一定环境胁迫下具有协同互补作用[30], 这与前人对盐芥(Thellungiella halophila)[29]的研究结果一致。在相同盐浓度下添加硅显著提高了SOD、POD和CAT活性, 这与前人对甘草(Glycyrrhiza uralensis)[31]、玉米(Zea mays)[32]、黄瓜[28]、小獐毛(Aeluropus littoralis)[6]等研究结果趋同, 说明在盐胁迫下硅通过提高高羊茅体内的SOD、POD和CAT酶活性, 增强对自由基的清除能力来提高其耐盐性。
渗透调节能力也是植物抗逆能力的体现, 植物体内可溶性糖、可溶性蛋白和丙二醛含量的多少直接反映膜的通透性和膜脂过氧化及对逆境的响应程度[33]。本研究表明, 高羊茅幼苗体内可溶性糖和可溶性蛋白含量随盐浓度增加呈先上升后下降的趋势, 丙二醛含量呈上升趋势。原因可能是较高盐浓度对可溶性蛋白和可溶性糖渗透调节功能造成破坏, 表现为可溶性蛋白和可溶性糖含量降低, 丙二醛含量显著增加, 生物量不再增加, 这与对鹅耳枥幼苗(Carpinus turczaniowii)[34]和蒌蒿(Artemisia selengensis)[35]的研究结果一致。相同盐浓度下, 添加硅降低了高羊茅幼苗体内可溶性糖、可溶性蛋白和丙二醛含量, 此结果在小獐毛[6]、番茄[9]、玉米[36]等植物中也得到了证实。原因可能是硅能够抑制因盐胁迫造成伤害而导致高羊茅幼苗膜透性增大的趋势, 降低植株对可溶性糖和可溶性蛋白的累积, 使得高羊茅植株在较低的可溶性糖和可溶性蛋白含量下有较好的保水能力[12, 22, 27]。说明硅能改善盐胁迫下高羊茅幼苗的渗透调节过程, 降低膜质过氧化作用, 提高高羊茅幼苗的耐盐性。
由此可见, 在盐浓度≤ 200 mmol· L-1的条件下, 硅能通过提高高羊茅植株体内抗氧化酶活性增强清除自由基的能力, 维持活性氧积累与清除的平衡, 改善渗透调节过程, 降低膜质过氧化作用对细胞的伤害从而增强高羊茅对盐胁迫的适应性, 维持其正常生长发育。
(责任编辑 武艳培)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|




