采用超声协同酶法提取紫花苜蓿多酚.以多酚提取量为指标,考察了液料比,加酶量,酶解时间,超声时间,超声温度及pH 6个因素对多酚提取效果的影响,并通过响应面法优化该提取工艺.同时探讨其抗氧化活性.结果表明,超声协同酶法提取紫花苜蓿多酚的最佳工艺条件为酶量4.9%,超声时间74 min,超声温度49 ℃,多酚提取量可达3.642 mg·g-1.此外,紫花苜蓿多酚具有较好的抗氧化活性,其清除DPPH和·OH自由基的半数抑制浓度IC50分别为10.78和19.28 μg·mL-1.
The polyphenols from alfalfa were extracted by ultrasonic-enzyme synergistic method. The effects of liquid-solid ratio, enzyme addition volume, enzyme incubation time, ultrasonic time, ultrasonic temperature and pH on phenol yield of alfalfa were investigated, and the extraction technology was optimized by response surface experiment. The antioxidant activities of alfalfa phenols were also studied. The results showed that the optimum technology factors for extracting alfalfa phenols were as follows: enzyme addition was 4.9%, ultrasonic time was 74 min and ultrasonic temperature was 49 ℃. Under this condition, the highest extraction quantity of total phenols could reach 3.642 mg·g-1. In addition, the phenols showed strong activities for DPPH (2,2-diphenyl-1-picrylhydrazyl) and hydroxyl radical scavenging, and the half scavenging concentration (IC50) of DPPH and ·OH radicals were 10.78 μg·mL-1 and 19.28 μg·mL-1, respectively.
紫花苜蓿(Medicage stativa)为多年生豆科苜蓿属植物, 在我国长江西北, 华北, 东北, 西北地区均有种植, 是我国的主产牧草之一, 因其强适应性, 高产草量, 营养均衡且品质极佳等优点而被誉为是"牧草之王"[1, 2, 3].研究表明, 紫花苜蓿中含有蛋白质, 黄酮, 多糖, 挥发油, 香豆素以及多酚等多种活性成分, 具有很高的药用价值[4, 5, 6, 7, 8, 9].多酚类化合物是形成植物固体部分的重要组成物质, 具有抗氧化, 抗肿瘤, 预防高血压, 抗血栓, 抗菌, 抗炎等生物活性及具有皮肤保健, 美容等功能[10, 11, 12, 13, 14], 因而受到国内外学者的广泛关注.但目前为止有关紫花苜蓿中多酚类物质的研究报道仍然较少.刘杰等[15]采用Folin-Ciocaileu 比色法对苜蓿种子中总多酚的含量进行了检测, 其含量为3.03~4.88 mg· g-1; 燕雪花等[16]采用乙醇回流法对新疆不同地区紫花苜蓿总多酚进行了提取, 结果表明, 不同产地紫花苜蓿总多酚含量存在显著差异.
超声协同酶提取方法能最大限度破坏细胞壁, 增大其通透作用, 有利于细胞内含物渗出, 进而大大增加植物有效成分的提取量, 且能保持其它物质的原生结构, 成为目前植物成分提取的热门方法之一[17, 18, 19].笔者采用超声协同酶法对河北省怀来县紫花苜蓿多酚的提取工艺进行了探讨, 建立紫花苜蓿中多酚提取的新方法, 并研究了其提取物清除DPPH自由基和· OH自由基的能力, 旨在为紫花苜蓿的开发提供理论依据.
紫花苜蓿, 2015年2月采集于河北省怀来县, 用去离子水洗净晾干后, 于50 ℃ 烘箱中烘干24 h, 粉碎, 过0.25 mm筛, 于干燥器中保存备用.没食子酸对照品(HPLC≥ 98%), 中国药品生物制品检定所; 纤维素酶为江苏锐阳生物科技有限公司生产, 5万U· g-1; 维生素C(Vc)标准品(HPLC≥ 99%), 上海金穗生物科技有限公司; K3Fe(CN)6, FeCl3, 磷酸氢二钠, 邻二氮菲, 柠檬酸及乙醇等试剂均为分析纯.
1.2.1 没食子酸标准曲线的建立 精密称取没食子酸对照品19.70 mg, 加50%乙醇溶解定容至50 mL, 配成浓度为394.0 μ g· mL-1溶液, 再移取4 mL该溶液用50%乙醇稀释成100 mL, 配成浓度为15.76 μ g· mL-1的没食子酸标准溶液备用.精确量取没食子酸标液0.2, 0.4, 0.6, 0.8, 1.0, 1.2和1.4 mL, 分别置于10 mL容量瓶中, 依次加入浓度均为0.100 mol· L-1的HCl溶液, FeCl3溶液和K3Fe(CN)6溶液各0.5 mL, 摇匀, 用50%乙醇定容后于室温避光放置20 min, 以不加没食子酸标液的相应溶液作空白, 在700 nm处测定吸光度, 重复3次, 取平均值绘制没食子酸质量浓度与吸光度的标准曲线.所得回归方程为:y=0.198 1x+0.001 33, R2=0.999 2, 式中y为标液的吸光度, x为没食子酸的质量浓度(μ g· mL-1).
1.2.2 紫花苜蓿多酚含量的提取工艺及测定 精确称取适量的紫花苜蓿粉末于10 mL比色管中, 加入一定量纤维素酶, 用50%乙醇溶液定容至刻度, 在适当的酶解温度, 时间和pH下, 按照设定的条件进行酶法提取后, 升温到90 ℃ 灭酶10 min, 再转入超声仪中, 用按照设定的程序进行超声波辅助法提取紫花苜蓿中的多酚, 抽滤, 滤液定容待测.
取2.0 mL上述提取液, 按一定比例稀释, 用紫外分光光度计按照1.2.1法测定其吸光度, 根据回归方程标准曲线, 按下式计算紫花苜蓿多酚的提取率.
多酚提取量=
式中, ρ 为紫花苜蓿提取液多酚的质量浓度(mg· mL-1); n为提取液稀释因子; V为提取液体积(mL); W为紫花苜蓿粉末的质量(g).
1.3.1 单因素试验 分别对液料比, 加酶量, 酶解时间, 超声时间, 超声温度及pH共6个因素进行单因素试验, 探究各因素对紫花苜蓿多酚提取效果的影响.
1.3.2 响应面试验设计 采用响应面法中Box-Behnken Design(BBD)中心组对紫花苜蓿多酚的超声协同酶法提取工艺进行优化.在对单因素结果进行分析后, 应用Design-Expert V 8.0.6软件进行试验设计, 以加酶量(X1), 超声时间(X2)及超声温度(X3)为独立变量, 以紫花苜蓿多酚提取量为响应值, 以二次多项式逐步回归分析优化提取条件, 响应面因素与水平见表1.
| 表1 响应面因素与水平表 Table 1 Factors and levels of response surface methodology |
1.3.3 验证与比较试验 过软件分析获得最佳提取工艺条件后, 按照优化条件进行提取测定, 比较试验结果和方程计算值的差异.
依据上述最佳工艺条件提取紫花苜蓿多酚, 并参照陈玮琦等[20]纯化苹果(Malus sieversii)枝条多酚的方法, 采用AB-8大孔吸附树脂对提取液进一步纯化, 再将纯化液稀释成不同质量浓度梯度的溶液备用.以清除DPPH和· OH自由基的能力为指标, Vc作为参照, 对比紫花苜蓿多酚及Vc在同一质量浓度下抗氧化活性的大小.
1.4.1 清除DPPH自由基 各取2.0 mL不同质量浓度的紫花苜蓿多酚纯化液于10 mL具塞试管中, 分别加入2.0 mL 0.08 mg· mL-1的DPPH 溶液, 摇匀, 待反应30 min后, 离心, 于517 nm处测定其上清液的吸光度, 标记为Ax1; 另各取2.0 mL 不同质量浓度的紫花苜蓿多酚纯化液于10 mL具塞试管中, 分别加入2.0 mL无水乙醇, 在波长517 nm 处测其吸光度, 标记为 Ax2; 反应30 min后的2.0 mL 0.08 mg· mL-1 的DPPH溶液和2.0 mL 无水乙醇混合液做为参比, 其吸光度标记为A0.平行测定3次, 取平均值, 依照下式计算DPPH的清除率.VC 清除DPPH的对照试验方法同上.
DPPH 自由基清除率=(1-
1.4.2 清除· OH自由基 取8支20 mL容量瓶, 分别加入4.0 mL pH为7.4的NaH2PO4-Na2HPO4缓冲液, 1.5 mL 7.5 mmol· L-1的邻二氮菲溶液, 1.0 mL 7.5 mmol· L-1 FeSO4和 1.0 mL 0.1% H2O2, 再加入2.0 mL一定质量浓度梯度的紫花苜蓿多酚纯化液, 摇匀, 用9 mmol· L-1水杨酸-乙醇溶液定容.放置于37 ℃ 恒温水浴中反应60 min, 测定其在536 nm 处的吸光度, 标记为Ax; 以不加紫花苜蓿多酚纯化液的上述溶液为空白对照, 其在536 nm 处的吸光度标记为A0.平行测定3次, 取平均值, 依照下式计算· OH自由基的清除率.VC 清除· OH自由基的对照试验方法同上.
· OH自由基清除率=
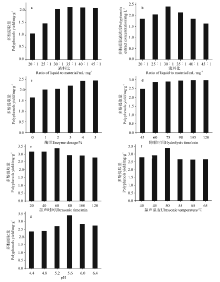
2.1.1 液料比对多酚提取量的影响 固定酶量为2%, 酶解时间为60 min, 超声时间为30 min, 超声温度为50 ℃ , pH为4.8, 考察不同液料比对多酚提取效果的影响(图1a).随着液料比的增大, 紫花苜蓿多酚的提取量随之增加, 提取液质量浓度则呈先增加后减少的趋势(图1b), 在液料比为30:1时, 多酚提取量基本达到平衡, 而提取液质量浓度达到最大值.这可能是因为随着液料比的增大, 溶剂所占比例增加, 使得紫花苜蓿粉末与溶剂的接触面积大大增加, 有利于多酚类物质的溶出, 减小传质阻力, 但同时也增加了浓缩成本, 为此本试验选择最佳料液比为30:1.
2.1.2 加酶量对多酚提取率的影响 固定液料比为30:1, 酶解时间为60 min, 超声时间为30 min, 超声温度为50 ℃ , pH为4.8, 考察不同酶添加量对多酚提取量的影响(图1c).添加纤维素酶1%~5%(酶与紫花苜蓿粉的质量百分数)比未添加纤维素酶(0)的提取效果明显增加, 随着纤维素酶含量的增加, 提取量随之增加, 到4%时趋于平衡.这是因为在酸性条件下, 纤维素酶能通过催化作用破坏紫花苜蓿的细胞壁, 增加其通透性, 降低多酚溶出的传质阻力, 但是随着纤维素酶含量的增加, 溶液中酶与底物浓度达到饱和状态, 故多酚含量不再增加.因此, 本试验选择纤维素酶的最佳添加量为4%.
2.1.3 酶解时间对多酚提取率的影响 固定液料比为30:1, 加酶量4%, 超声时间为30 min, 超声温度为50 ℃ , pH为4.8, 考察添加不同酶解时间对多酚提取量的影响(图1d).紫花苜蓿的提取量随着酶解时间的增加而增加, 当酶解时间达到105 min后达到最大值.这是因为随着反应时间延长, 酶解反应越充分, 多酚含量溶出越完全, 当酶解时间为105 min时, 多酚类物质已基本溶出, 因此, 延长酶促时间并不能提高提取效果, 反而有可能会导致多酚类物质遭到破坏.为此, 本试验选择最佳酶解时间为105 min.
2.1.4 超声时间对多酚提取量的影响 固定液料比为30:1, 加酶量4%, 酶解时间为105 min, 超声温度为50 ℃ , pH为4.8, 考察不同超声时间对多酚提取量的影响(图1e).超声波的破壁效应和热效应能使埋藏在细胞内部的多酚类物质彻底溶解出来, 随着时间增长, 细胞通透性增加, 多酚的自溶速率增快, 因此紫花苜蓿多酚提取量逐渐增加.当达到60 min时多酚提取量达到最大值, 而后提取效果急剧减弱, 这可能是因为随着时间的延长细胞内外多酚类物质浓度差减小, 传质阻力增加, 不利于多酚的溶出, 且由于时间过长, 易导致多酚类物质结构被破坏.故本试验选择最佳超声时间为60 min.
2.1.5 超声温度对多酚提取量的影响 固定液料比为30:1, 加酶量4%, 酶解时间为105 min, 超声时间为60 min, pH为4.8, 考察不同超声温度对多酚提取量的影响(图1f).在40~50 ℃ 范围内紫花苜蓿多酚的提取量随着超声温度的升高而明显增大, 这是因为随着温度升高, 溶剂和多酚类物质的渗透, 扩散和溶解能力大大增加, 使得多酚类物质提取量明显增大.当超声温度超过50 ℃ 时, 可能由于多酚类物质发生氧化, 品质发生变化而导致检测不出, 因而提取量出现明显下降.为此, 本试验选择最适宜提取的超声温度为50 ℃ .
2.1.6 pH对多酚提取率的影响 固定液料比为30∶ 1, 酶量为4%, 酶解时间为105 min, 超声时间为30 min, 超声温度为50 ℃ , 考察不同pH值对多酚提取量的影响(图1g), pH为5.6时, 紫花苜蓿多酚的提取量达到最大值, 这说明pH=5.6为纤维素酶提取紫花苜蓿多酚的最佳pH值.在此pH值时, 纤维素酶能发挥其最大活性, 最大限度地破坏紫花苜蓿的细胞壁, 降低传质阻力, 提高紫花苜蓿多酚的溶出效率.此外, 多酚类物质容易以氢键的方式键合在一起, 在弱酸性条件下有利于破坏氢键促使多酚类物质的彻底释放, 因此, 本研究选择pH为5.6作为最佳试验pH值.
2.2.1 响应面试验结果及方差分析 根据Box-Benhnken的中心组合试验设计原理, 选取对紫花苜蓿多酚提取效果影响较大的3个因素:酶量(X1), 超声时间(X2)和超声温度(X3)进行优化试验, 试验因素和水平设计表见表2, 响应面分析方案见表3.
| 表2 响应曲面试验以及响应值 Table 2 Experiment design and result of response surface method analysis |
| 表3 响应曲面方差分析表 Table 3 Variance analysis of regression equation |
采用Design-Expert V8.0.6软件对表2进行回归拟合, 得到的拟合方程为Y=-40.35+0.461 0X1+0.144 0X2+1.565X3+5.225× 10-3X1X2-0.017 42X1X3-6.618× 10-4X2X3+0.031 63
由方差分析可知, 一次项X1, X2, X3及二次项
2.2.2 最佳工艺条件的优化及验证 对所建立的模型进行参数优化, 得到该模型的最佳提取工艺为酶量4.86%, 超声时间74.44 min, 超声温度49.17 ℃ , 在此条件下提取量最大预测值可达3.665 mg· g-1.为检验该回归模型预测结果的可靠性, 对上述预测的最佳工艺条件进行优化验证.为方便操作, 将此工艺条件修正为酶量4.9%, 超声时间74 min, 超声温度49 ℃ , 进行3次平行试验, 得到的实际提取量为3.642 mg· g-1, 略低于理论预测值, 相对误差仅为0.63%, 说明该模型较好地预测了理论提取量, 超声联合酶法提取紫花苜蓿多酚的工艺具有实际应用价值.
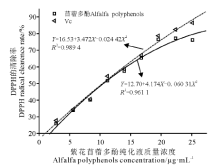
在2.79~25.13 μ g· mL-1范围内DPPH的清除率与紫花苜蓿多酚的质量浓度呈正相关, 当质量浓度为25.13 μ g· mL-1时, 紫花苜蓿多酚对DPPH自由基的清除率可达到76.23%(图2).与Vc相比, 紫花苜蓿多酚对DPPH的清除率呈先增加后趋于平稳的趋势, 而Vc则始终保持增加的状态.当质量浓度低于19.54 μ g· mL-1时紫花苜蓿多酚及Vc对DPPH的清除率基本一致.紫花苜蓿多酚质量浓度(X) 与清除率(Y) 的回归方程为Y=12.70+4.174X-0.060 31X2 (R2=0.961 1), 紫花苜蓿多酚清除50%DPPH自由基的半数抑制浓度IC50值为10.78 μ g· mL-1, Vc的质量浓度(X) 与清除率(Y) 的回归方程为Y=16.53+3.472X-0.024 42X2 (R2=0.989 4), Vc的IC50为10.54 μ g· mL-1, 两者数值相近, 表明紫花苜蓿多酚具有较强清除DPPH自由基的能力.
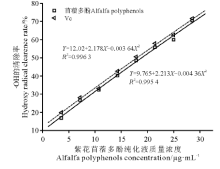
随着质量浓度的增加, 紫花苜蓿提取液多酚和Vc对· OH自由基的清除率不断增大, 且两者的趋势基本一致(图3).当紫花苜蓿多酚质量浓度为28.54 μ g· mL-1时, 其对DPPH自由基的清除率达到70.58%.紫花苜蓿多酚清除50%· OH自由基的半数抑制浓度IC50值为19.28 μ g· mL-1与Vc的IC50值(18.13 μ g· mL-1)相差不大, 表明紫花苜蓿多酚同样具有较强清除· OH自由基的能力.
采用响应面法优化超声协同酶法提取紫花苜蓿多酚的工艺, 同时对提取产物进行了一系列清除DPPH和· OH自由基的体外抗氧化性试验研究.得出提取紫花苜蓿多酚的最佳工艺条件为:酶量4.9%, 超声时间74 min, 超声温度49 ℃ , 多酚提取量可达3.642 mg· g-1, 与预测值相比相对误差仅为0.63%; 此外, 紫花苜蓿多酚对DPPH和· OH自由基均具有有较好的清除效果, IC50分别为10.78 μ g· mL-1和19.28 μ g· mL-1, 表明紫花苜蓿多酚可作为一种天然, 有效的抗氧化剂, 有望广泛应用于医药, 食品及美容等行业.
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|